Koulutuksen kationi, erot anionin ja esimerkkien kanssa

- 5051
- 874
- Dr. Travis Reichert
Eräs kationi Se on kemiallinen laji, jolla on positiivinen varaus. Kaksi olemassa olevia ioneja ovat anionille. Sen kuorma on atomin elektronien puutteen tuote, mikä aiheuttaa ydinprotonien käyttämisen suuremman vetovoiman. Jokaiselle neutraalin atomin menettää elektronille positiivinen kuorma kasvaa yksikössä.
Jos atomi menettää elektronin, ja siksi protonien lukumäärä on suurempi kuin yksi, sen positiivinen kuorma on +1; Jos menetät kaksi elektronia, kuorma on +2 ja niin edelleen. Kun kationilla on +1 -kuorma, sen sanotaan olevan yksiarvoinen; Toisaalta, jos mainittu kuorma on suurempi kuin +1, sanotaan, että kationi on monipuolinen.
 Hydronio -ioni, yksi yksinkertaisimmista kationien kationeista. Lähde: Gabriel Bolívar.
Hydronio -ioni, yksi yksinkertaisimmista kationien kationeista. Lähde: Gabriel Bolívar. Yläkuvassa se on osoitettu kationin h3JOMPIKUMPI+, nimeltään hydronio -ioni. Kuten voidaan nähdä, sillä on tuskin +1 -kuorma, monovordentin kationin mukaisesti.
Kationit ovat tärkeitä lajeja, koska niillä on sähköstaattinen voima ympäristössään ja ympärillä olevat molekyylit. Niillä on korkea vuorovaikutus veden kanssa, neste, joka hydroi ja kuljettaa ne märässä maaperässä, ja sitten ne saavuttavat kasvien juuret ja niitä käytetään fysiologisiin toimintoihinsa.
[TOC]
Kuinka kationi muodostuu?
Mainittiin, että kun atomi menettää elektronin, sen eniten protoneja suhteessa elektroneihin kohdistaa vetovoiman, joka tarkoittaa positiivista kuormaa. Mutta miten elektronien menetys voi tapahtua? Vastaus riippuu kemiallisissa reaktioissa tapahtuneesta muutoksesta.
On huomattava, että atomin läsnäolo positiivisella kuormalla ei välttämättä tarkoita kationin muodostumista. Niin, että sitä voidaan pitää sellaisenaan, negatiivisella muodollisella kuormituksella ei pitäisi olla atomia. Muutoin samassa yhdisteessä olisi vetovoima ja torjuminen ja se olisi neutraalia.
Voi palvella sinua: kalsiumsulfaatti (tapaus4): kemiallinen rakenne, ominaisuudet, käyttötarkoituksetMuodolliset maksut ja muut linkit
Elektronegatiiviset atomit houkuttelevat kovalenttisten sidosten elektroneja heitä kohti. Vaikka elektronit jaetaan tasa -arvoisesti, on piste, jossa heillä on osittain vähemmän elektroneja kuin niiden peruskokoonpanossa; Tämä on heidän vapaiden atomiensa, jotka eivät ole yhteydessä muihin elementteihin.
Sitten nämä elektronegatiiviset atomit alkavat kokea elektronien puutetta, ja sen kanssa niiden ytimien protoneilla on suurempi vetovoima; Positiivinen muodollinen kuorma syntyy. Jos muodollinen kuorma on vain positiivinen, yhdiste osoittaa globaalin positiivisen ionisen kuorman; Siten kationi syntyi.
Kationin h happiatomi3JOMPIKUMPI+ Se on uskollinen esimerkki yllä olevasta. Koska sinulla on kolme O-H-sidosta, yksi enemmän kuin vesimolekyylissä (H-O-H), kokee elektronin menetyksen sen perustilan suhteen. Muodollisten kuormien laskelmat sallivat määrittää, milloin tämä tapahtuu.
Jos toisen O-H: n muodostumisen oletetaan hetkeksi, kaksiarvoinen kationi saadaan4JOMPIKUMPI2+. Huomaa, että kaksiarvoinen kuorma kationin päälle kirjoitetaan seuraavasti: numero seurasi '+' -symbolia; Samoin anionit jatketaan.
Hapetus
Metallit ovat kationin muotoilijoita par excellence. Kaikki eivät kuitenkaan voi muodostaa kovalenttisia sidoksia (tai ainakin puhtaasti kovalenttia). Sen sijaan he menettävät elektroneja ionisten sidosten luomiseksi: positiivinen kuorma houkuttelee negatiivista, fyysisten voimien yhdistämistä.
Siksi metallit menettävät elektronit siirtymään M: stä M: henn+, missä n Se on yleensä yhtä suuri kuin ryhmäsi lukumäärä jaksollisessa taulukossa; siitä huolimatta n Voit ottaa useita kokonaisia arvoja, jotka tapahtuvat etenkin siirtymämetallien kanssa. Tämä elektronien menetys suoritetaan tyyppisessä kemiallisessa reaktiossa, jota kutsutaan hapetukseksi.
Voi palvella sinua: tertiäärinen alkoholi: rakenne, ominaisuudet, esimerkitMetallit hapettuu, menettävät elektronin, niiden atomien protonien lukumäärä ylittää elektronien, ja siten niillä on positiivinen kuorma. Jotta hapettuminen olisi, on oltava hapettumisaine, joka vähentää tai saa elektroneja, jotka metallit menettävät. Happi on kaikkien tunnetuin hapettava aine.
Erot anionin kanssa
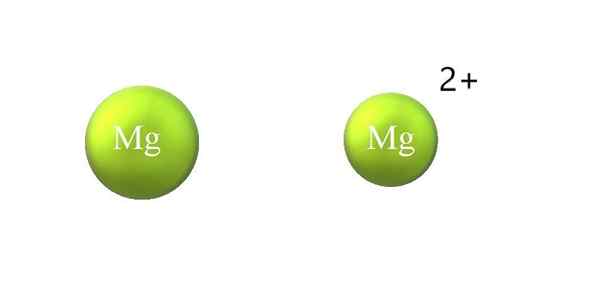 Atomis säteen supistuminen kationissa. Lähde: Gabriel Bolívar.
Atomis säteen supistuminen kationissa. Lähde: Gabriel Bolívar. Alla on eroja kationin ja anionin välillä:
-Yleinen kationi on pienempi kuin anioni. Yläkuva osoittaa, kuinka MG: n atomisäde vähenee menettämällä kaksi elektronia ja tulemalla MG -kationiksi2+; Päinvastoin tapahtuu anionien kanssa: niistä tulee tilaa vieviä.
-Siinä on enemmän protoneja kuin elektronit, kun taas anionilla on enemmän elektroneja kuin protoneihin.
-Pienemmäksi sen kuormitustiheys on korkeampi, ja siksi sillä on suurempi polarisointivoima; toisin sanoen deformoi naapuriatomien elektroniset pilvet.
-Kationi liikkuu samaan suuntaan kuin sovellettu sähkökenttä, kun taas anioni tekee niin vastakkaiseen suuntaan.
Esimerkkejä yleisimmistä kationeista
Monoatominen
Monoatomiskationit tulevat enimmäkseen metalleista (lukuun ottamatta tiettyjä poikkeuksia, kuten H+-A. Muista on erittäin harvinaista harkita kationia, joka on johdettu ei -metallisesta elementistä.
Nähdään, että monet heistä ovat di: tä tai monipuolisia ja että heidän kuormansa suuruudet ovat yhtä mieltä heidän ryhmien lukumäärän kanssa jaksollisessa taulukossa.
Se voi palvella sinua: Ribulosa-1,5-bifosfaatti (RUBP): Ominaisuudet, karboliksointi-Li+
-Naa+
-K -k -+
-RB+
-CS+
-Fr+
-Ag+
Kaikilla on yhteinen kuorma '1+', joka on kirjoitettu asettamatta numeroa, ja ne tulevat myös ryhmästä 1: alkalimetallit. Lisäksi siellä on kationi+, Yksi yleisimmistä siirtymämetalleista.
-Olla2+
-Mg2+
-Ac2+
-Herra2+
-Ba2+
-Rata2+
Nämä kaksiarvoiset kationit johtuvat vastaavista metalleistaan, jotka kuuluvat ryhmään 2: alkalinerior -metallit.
-Siihen3+
-Ga3+
-Sisään3+
-Tl3+
-Nh3+
Boro -ryhmän kolmiulotteiset kationit.
Toistaiseksi esimerkkejä on karakterisoitu, että sillä on yksi valenssi tai lastaus. Muilla kationilla on enemmän kuin yksi valenssi tai positiivinen hapettumistila:
-Sn2+
-Sn4+ (tina)
-Yhteistyö2+
-Yhteistyö3+ (koboltti)
-Au+
-Au3+ (kulta)
-Usko2+
-Usko3+ (rauta)
Ja muilla metalleilla, kuten mangaanilla, voi silti olla paljon enemmän valensseja:
-Mn2+
-Mn3+
-Mn4+
-Mn7+
Mitä suurempi kuorma, pienempi ja polarisointi on kationi.
Polyiatominen
Menemättä orgaaniseen kemiaan, on epäorgaanisia ja polyloamisia kationeja, jotka ovat hyvin yleisiä jokapäiväisessä elämässä; kuten:
-H3JOMPIKUMPI+ (Hydonio, jo mainittu).
-Nh4+ (ammonium).
-EI2+ (Nitronio, läsnä nitraatioprosesseissa).
-PHE4+ (Fosfonium).
Viitteet
- Whitten, Davis, Peck & Stanley. (2008). Kemia. (8. ed.-A. Cengage -oppiminen.
- Helmestine, Anne Marie, PH.D -d. (5. toukokuuta 2019). Määritelmä ja esimerkki kationista. Toipunut: Admingco.com
- Wyman Elizabeth. (2019). Kation: Määritelmä ja esimerkki. Opiskelu. Toipunut: Opiskelu.com
- Nukke. (2019). Positiivinen ja negatiivinen INS: kationit ja anionit. Toipunut: nukkeja.com
- Wikipedia. (2019). Kationi. Palautettu: on.Wikipedia.org
- « Anisolirakenne, ominaisuudet, nimikkeistö, riskit ja käyttötarkoitukset
- Arkeoliittinen alkuperä, ominaisuudet, ilmasto, kasvisto ja eläimistö »

