Anisolirakenne, ominaisuudet, nimikkeistö, riskit ja käyttötarkoitukset
- 2198
- 20
- Gustavo Runte DVM
Hän anisoli tai metoksibentseeni Se on orgaaninen yhdiste, joka koostuu aromaattisesta eetteristä, jonka kemiallinen kaava on c6H5Kisko3. Hänen fyysinen kunto on väritön neste, joka voi esiintyä keltaisia värejä. Se tunnistetaan helposti sen tyypillisellä Anis -hajulla.
Se on sitten haihtuva yhdiste eikä kovin korkea koheesiovoimia; Tavalliset ominaisuudet kevyissä eettereissä, joita säilytetään pienissä suljetuissa astioissa. Erityisesti anisoli on yksinkertaisin alkyyliaurileetteristä; eli ne, joilla on aromaattinen komponentti (AR) ja toinen alkyyli (R), AR-O-R.
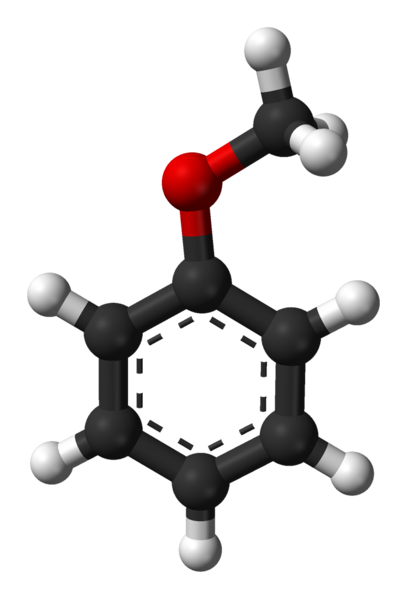
 Anisolimolekyyli. Lähde: Ben Mills Wikipedian kautta.
Anisolimolekyyli. Lähde: Ben Mills Wikipedian kautta. Ryhmä C6H5- Tulee merkitsemään AR: ta ja -CH: ta3 A r, siten C6H5-O-CH-CH-3. Aromaattinen rengas ja -ochin läsnäolo3 Metoxi -nimisenä substituenttiryhmänä anisoli antaa nukleofiilisyyden, joka on parempi kuin bentseenin ja nitrobentseenin,. Siksi se toimii välittäjämolekyylinä farmakologisen aktiivisuuden yhdisteiden synteesissä.
Sen tyypillistä anishajua on käytetty anisolin lisäämiseen kosmeettisiin ja hygieniatuotteisiin, jotka vaativat miellyttävää tuoksua.
[TOC]
Anisolirakenne
Yläkuvassa anisolin molekyylirakenne on esitetty pallo- ja baarimallin avulla. Aromaattinen rengas arvostetaan, joiden hiilet ovat SP2 ja siksi se on litteä, kuusikulmainen arkki; Ja hänen linkitetty häneen on Metoxi -ryhmä, jonka hiili on SP3, ja sen vety on rengastason ylä- tai alapuolella.
-Och -ryhmän merkitys3 Rakenteessa se ylittää molekyylin tasaisen geometrian hajoamisen rakenteen: se antaa sille polaarisuuden, ja siten bentseenin apolarimolekyyli saa pysyvän dipolimomentin.
Dipolaarinen hetki
Tämä dipolimomentti johtuu happiatomista, joka houkuttelee sekä aromaattisen että metyylirenkaan elektronisia tiheyksiä. Tämän ansiosta Anisolin molekyylit voivat olla vuorovaikutuksessa puoli-dipolovoimia; Vaikka sillä ei ole mahdollisuutta muodostaa vety siltoja, koska se on eetteri (ROR: lla ei ole happea).
Voi palvella sinua: natriumkloridi (NaCl)Sen korkea kiehumispiste (154ºC), kokeellisesti todistaa sen nestettä hallitsevat voimakkaat molekyylien väliset vuorovaikutukset. Samoin Lontoon dispersiovoimia on läsnä, riippuen molekyylimassasta ja π -π -vuorovaikutuksista itse renkaiden välillä.
Kiteet
Anisolin rakenne ei kuitenkaan salli häntä.F = -37ºC). Tämä voi johtua myös tosiasiasta.
Siksi ja kristallografisten tutkimusten mukaan kiteissä olevia anisolimolekyylejä -173ºC: n lämpötilassa ei voida tilata siten, että niiden renkaat kohtaavat; toisin sanoen sen aromaattiset keskukset eivät ole linjassa keskenään, vaan ryhmä -och3 Se on ylös tai naapurirenkaan alla.
Ominaisuudet
Fyysinen ulkonäkö
Väritön neste, mutta se voi esiintyä mietovärisiä olkiääniä.
Haju
Se tuoksuu hieman samanlaiselta kuin anis siemenet.
Maku
Makea; Se on kuitenkin kohtalaisen myrkyllinen, joten tämä testi on vaarallinen.
Molekyylimassa
108 140 g/mol.
Tiheys
0,995 g/ml.
Höyryn tiheys
3,72 (ilmasuhteessa = 1).
Sulamispiste
-37ºC.
Kiehumispiste
154ºC.
sytytyspiste
125ºC (avoin kuppi).
Itsensuuntainen lämpötila
475ºC.
Goo
0,778 CP 30ºC: n lämpötilassa.
Pintajännitys
34,15 DINS/cm A 30ºC.
Taitekerroin
1 5179 - 20ºC.
Liukoisuus
Huonosti liukoinen veteen (noin 1 mg/ml). Muissa liuottimissa, kuten asetonissa, eettereissä ja alkoholissa, se on kuitenkin kovin liukoinen.
Nukleofiilisyys
Anisolin aromaattinen rengas on runsaasti elektroneja. Tämä johtuu siitä, että happi, vaikka se on erittäin elektronegatiivinen atomi, myötävaikuttaa π -pilven elektronien kanssa purkaakseen ne renkaan läpi lukuisissa resonanssirakenteissa. Tämän seurauksena enemmän elektroneja kulkee aromaattisen järjestelmän ja lisää siksi sen nukleofiilisyyttä.
Se voi palvella sinua: Kamfikas alkoholi: rakenne, kaava, ominaisuudet ja käyttötarkoituksetKokeellisesti nukleofiilisyyden lisääntyminen on osoitettu vertaamalla sen reaktiivisuutta aromaattisten elektrofyylisten substituutioiden edessä bentseenin kanssa. Siten -och -ryhmän huomattava vaikutus todistetaan3 Yhdisteen kemiallisista ominaisuuksista.
On myös huomattava, että elektrofiiliset substituutiot tapahtuvat vierekkäisissä asennoissa (-orto) ja vastakkaiset (-for) Metoxi-ryhmään; eli tämä on orto-for-ohjaaja.
Reaktiivisuus
Anisolin aromaattisen renkaan nukleofiilisyys antaa sinun jo vilkaista sen, kuinka sen reaktiivisuus on. Substituutiot voivat tapahtua joko renkaassa (sen nukleofiilisyyden suosima) tai samassa Metaxi -ryhmässä; Jälkimmäisessä O-CH-linkki on rikki3 -CH: n korvaaminen3 Toinen Alquilic-ryhmä: O-Alquilación.
Siksi alkylointiprosessissa anisoli voi hyväksyä ryhmän R (toisen molekyylin fragmentti), joka korvaa sen renkaan H (C-Living) tai CH: n korvaaminen3 Metoxi -ryhmästäsi. Seuraava kuva kuvaa juuri sanottua:
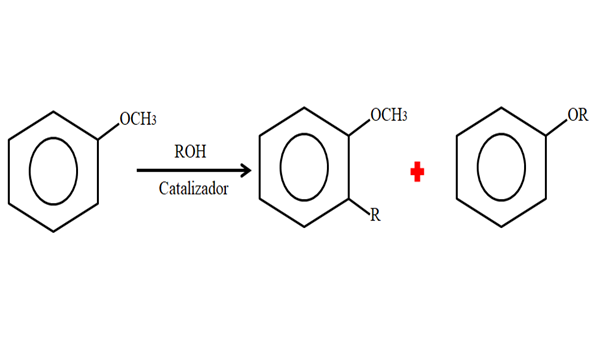 Anisolialkylointi. Lähde: Gabriel Bolívar.
Anisolialkylointi. Lähde: Gabriel Bolívar. Kuvassa R -ryhmä sijaitsee paikoillaan -orto, mutta se voi olla myös asennossa -3. Kun O -alquilación tapahtuu, uusi eetteri toisen ryhmän kanssa tai saadaan.
Nimikkeistö
Nimi 'anisol' on tunnetuin ja hyväksytty, todennäköisesti johdettu sen hajusta kuin anis. Nimi 'metoksibentseeni' on kuitenkin melko spesifinen, koska se vahvistaa heti, kun tämän aromaattisen eetterin rakenne ja identiteetti; Tämä on nimi, jota hallitsee systemaattinen nimikkeistö.
Toinen vähemmän käytetty nimi, mutta yhtä pätevä, on 'fenyylimetyylieetteri', jota säätelee perinteinen nimikkeistö. Tämä on ehkä kaikkien tarkempi nimi, koska se osoittaa suoraan, mitkä ovat eetterin kaksi rakenteellista osaa: foenyyli-o-metyyli, c6H5-O-CH-CH-3.
Riskejä
Lääketieteelliset tutkimukset eivät ole vielä pystyneet osoittamaan anisolin mahdollisia kuolevaisia vaikutuksia kehoon pieninä annoksina. Kuitenkin, kuten melkein kaikki kemialliset aineet, se aiheuttaa ärsytyksiä, kun liian aika altistuu ja kohtalaisina pitoisuuksina iholle, kurkkuun, keuhkoihin ja silmiin.
Voi palvella sinua: Amagat -laki: Selitys, esimerkit, harjoituksetHänen renkaan nukleofiilisyyden vuoksi osa siitä on metaboloitu ja siksi se on biohajoava. Itse asiassa tämän ominaisuuden seurauksena simulaatiot osoittivat, että se ei keskittyisi vesipitoisiin ekosysteemeihin, koska sen organismit ensin heikentävät sitä; Ja siksi joet, järvet tai meret voivat kerätä anisolia.
Maaperässä, koska sen volatiliteetti haihtuu nopeasti ja ilmavirrat vetävät; Siten vihannesmassat tai istutukset eivät vaikuta huomattavasti.
Toisaalta ilmakehän se reagoi vapaiden radikaalien kanssa, eikä siksi edusta hengittämää ilman pilaantumisen riskiä.
Sovellukset
Orgaaninen synteesi
Anisolista muut johdannaiset voidaan saada aromaattisella elektrofiilisellä korvauksella. Tämä mahdollistaa välittäjänä lääkkeiden, torjunta -aineiden ja liuottimien synteesille, jotka haluavat lisätä ominaisuuksiaan. Synteettiset reitit voivat koostua enimmäkseen.
Tuoksut
Orgaanisen synteesin käytön lisäksi sitä voidaan käyttää suoraan lisäaineena voiteille, voiteille ja hajuvesille, sisällyttämällä anti -tuoksut tällaisiin tuotteisiin.
Viitteet
- Morrison, r. T. ja Boyd, R, N. (1987). Orgaaninen kemia. 5. painos. Toimituksellinen Addison-Wesley Inter-American.
- Carey f. -Lla. (2008). Orgaaninen kemia. (Kuudes painos). MC Graw Hill.
- Graham Solomons t.W -., Craig B. Freedle. (2011). Orgaaninen kemia. Amiini. (10. painos.-A. Wiley Plus.
- Kansallinen bioteknologiatietojen keskus. (2019). Anisoli. Pubchem -tietokanta, CID = 7519. Toipunut: Pubchem.NCBI.Nlm.NIH.Hallitus
- Wikipedia. (2019). Anisoli. Haettu: vuonna.Wikipedia.org
- Pereira, Cynthia C. M., De la Cruz, Marcus H. C., & Lachter, Elizabeth R. (2010). Anisolin ja fenoli -katalysoidun niobiumfosfaatin nestemäinen faselaatio. Brasilian Chemical Society -lehti, 21 (2), 367-370. Dx.doi.org/10.1590/S0103-50532010000200025
- Seidel r. W -. ja Goddard R. (2015). Anisoli 100 K: ssa: Ensimmäinen kiderakenteen määritys. Kristallogrogr C -kemia. Elokuu; 71 (pt 8): 664-6. Doi: 10.1107/S2053229615012553
- Kemiallinen formulaatio. (2018). Metoksibentseeni. Palautettu: quimica -formulaatio.com

