Boorihapon kemiallinen rakenne, ominaisuudet, valmistus, käyttää

- 1373
- 134
- Gustavo Runte DVM
Hän boorihappo Se on epäorgaaninen yhdiste, jonka kemiallinen kaava on H3Bo3. Se koostuu valkoisesta tai värittömästä kiinteästä. Se on heikko happo, joka vesiliuoksessa tuottaa sen pitoisuudesta riippuen pH välillä 3,8 - 4,8. Se on vähän liukoinen kylmään ja kohtalaisen liukoiseen kuumaan veteen.
Wilhelm Man löysi boorihapon vuonna 1702.
 Kiinteä boorihapon näyte kellolasilla. Lähde: Walkerma Wikipedian kautta.
Kiinteä boorihapon näyte kellolasilla. Lähde: Walkerma Wikipedian kautta. Kuitenkin myös huomautetaan, että Boerg valmisti boorihapon lisäämällä vettä booraksille ja lämmittämällä liuosta sen haihtumiseen, jättäen siten sedimenttiin kryalihappikiteitä.
Tämä happo on erittäin hyödyllinen yhdiste, jolla on lukuisia sovelluksia teollisuudessa ja lääketieteessä.
[TOC]
Kemiallinen rakenne
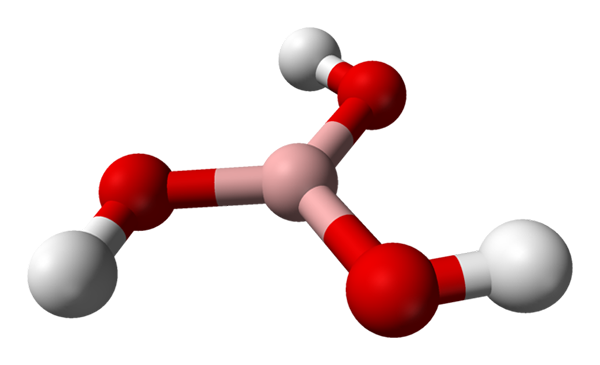 Boorihappomolekyyli, jota edustavat pallot ja baarimalli. Lähde: Benjah-BMM27 [julkinen alue]
Boorihappomolekyyli, jota edustavat pallot ja baarimalli. Lähde: Benjah-BMM27 [julkinen alue] Ylemmässä kuvassa meillä on itse molekyyli3Bo3. Huomaa, että vetyatomeja, joita valkoiset pallot edustavat, ei ole kytketty booriatomiin, kuten voisi viitata kemialliseen kaavaan; vaan pikemminkin happiatomeille, jotka edustavat punaisia palloja.
Siten boorihappo on B (OH), vaikka se on vähemmän käytetty vähemmän käytettyyn, helpompi kaava, vaikka se on vähemmän käytetty3, osoittaa, että niiden happamuus johtuu H -ioneista+ Vapautuneet heidän OH -ryhmästään. Molekyyli B (OH)3 Sillä on trigonaalinen tasainen geometria, booriatomilla on kemiallinen hybridisaatio SP2.
B (OH)3 Se on kovalenttinen korkeamolekyyli, koska booriatomin ja hapen välinen elektronegatiivisuuden ero ei ole kovin suuri; Joten B-O-linkit ovat pohjimmiltaan kovalenttisia. Huomaa, että tämän molekyylin rakenne muistuttaa kehruu rakennetta. Voinko käynnistää oman akselinsa samalla tavalla?
Kiteet
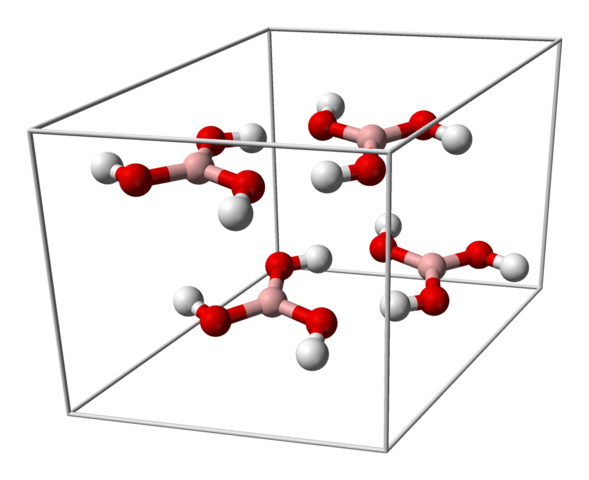 H3BO3 -kidelle yhtenäinen solu. Lähde: Benjah-BMM27 [julkinen alue]
H3BO3 -kidelle yhtenäinen solu. Lähde: Benjah-BMM27 [julkinen alue] Yläkuva näyttää yhtenäisen solun, joka vastaa boorihapon kolmipyöräilyn kiteistä rakennetta, joka tietyissä synteesiolosuhteissa voi omaksua kompakti kuusikulmainen rakenne. Huomaa, että yhtenäistä solua on neljä molekyyliä ja jotka on järjestetty kahteen kerrokseen, A ja B, vaihdetut (niitä ei ole päällekkäin päällekkäin).
B-OH-linkkien symmetrian ja ohjauksen vuoksi voidaan olettaa, että B (OH)3 Se on apolaarinen; Molekyylien välisten vety siltojen olemassaolo kuitenkin muuttaa historiaa. Jokainen B (OH) -molekyyli3 Antaa tai vastaanottaa kolme näistä sillasta, yhteensä kuusi dipoli-dipolo-vuorovaikutusta, kuten alla olevassa kuvassa havaitut:
Voi palvella sinua: terpenos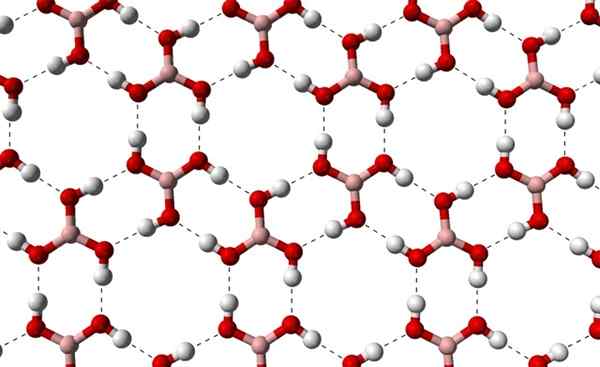 H3bo3: n kiteiset kerrokset, jotka on havaittu korkeammasta akselista. Lähde: Benjah-BMM27 [julkinen alue]
H3bo3: n kiteiset kerrokset, jotka on havaittu korkeammasta akselista. Lähde: Benjah-BMM27 [julkinen alue] Huomaa, että nämä vety sillat ovat suuntavuorovaikutuksia, jotka hallitsevat boorihappikiteitä, ja luovat koristeellisten näkökohtien malleja; Sisäiset renkaat, joilla on ehkä riittävä tila sulkea joitain epäpuhtauksia, jotka eivät ole kiteisiä vikoja.
Nämä vety sillat, B (OH) pienestä molekyylimassasta huolimatta3, He pitävät lasinsa yhtenäisenä, että hän tarvitsee lämpötilan 171 ºC sulaakseen. Ei tiedetä, mitkä vaikutukset olisivat korkeat paineet (GPA: n järjestyksessä) B (OH) -molekyylikerroksiin3.
Ominaisuudet
Nimeä
IUPAC: Borinihappo ja trihydrooksidobor. Muut nimet: Ortoboorihappo, borraatihappo, sassoliitti, borofax ja trihydroksiborano.
Moolimassa
61,83 g/mol
Fyysinen ulkonäkö
Kiteinen, väritön ja läpinäkyvä valkoinen kiinteä kiinteä aine. Se saavutetaan myös rakeina tai valkoisen pölyn muodossa. Hieman epämiellyttävä koskettaa.
Haju
Käymälö
Maku
Hieman katkera
Sulamispiste
170,9 ºC
Kiehumispiste
300 ºC
Vesiliukoisuus
Kohtuullisesti liukenee kylmään ja liukoiseen veteen kuumaan veteen:
2,52 g/100 ml (0 ºC)
27,50 g/100 ml (100 ºC)
Boorihappo on osittain liukoinen veteen ja taipumus uppoaa siihen. Tällä liukoisuudella on taipumus kasvaa happojen läsnä ollessa, kuten suolaki.
Liukoisuus muihin liuottimiin
-Glyseroli: 17,5 % 25 ° C: ssa
-Etyleeniglykoli: 18,5 % 25 ° C: ssa
-Asetoni: 0,6 % 25 ° C: ssa
-Etyyliasetaatti: 1,5 % 25 ° C: ssa
-Metanoli: 172 g/l a 25 ºC
-Etanoli: 94,4 g/l A 25 ºC
Oktanoli/vesijakokerroin
Loki p = -0,29
Happamuus (PKA)
9.24. 12.4. 13.3. Nämä ovat heidän vastaavan dissosiaationsa kolme vakiota H: n vapauttamiseksi+ Vedessä.
PHE
3,8 - 4,8 (3,3 % vesiliuoksessa)
5,1 (0,1 molaarista)
Höyrynpaine
1,6 · 10-6 mmhg
Vakaus
Vakaa vedessä
Hajoaminen
Se hajoaa, kun se lämmitetään yli 100 ºC, muodostaen boorihydridin ja veden.
Reaktiivisuus
Boorihappo muodostaa liukoisia suoloja, joissa on monovalenttiset kationit, esimerkiksi: NA2B -4JOMPIKUMPI7.10H2Tai ja liukenemattomat suolat kaksiarvoisilla kationilla, ohjaamo4JOMPIKUMPI7.6H2JOMPIKUMPI.
Vesipitoisessa liuoksessa se tuottaa happoliuoksen, ajatellen, että tämä ominaisuus johtui OH -ryhmien vähentämisestä- vettä. Boorihappo on pätevä Lewis -tyypin heikkona happona.
Boorihappo reagoi glyserolin ja mannitolin kanssa lisäämällä vesipitoisen ympäristön happamuutta. PKA on muokattu välillä 9,2-5, johtuen boro-manitol quelato-muodostumisesta [BC6H8JOMPIKUMPI2(VAI NIIN)2--, joka vapauttaa h+.
Valmistautuminen
Boorihappo on vapaassa tilassa vulkaanisissa säteilyissä alueilla, kuten Italian Toscana, Lipari -saaret ja Nevadan osavaltiossa, Yhdysvalloissa. Sitä löytyy myös mineraaleista, kuten Borax, Boracita, Ulexita ja Colemanita.
Voi palvella sinua: HalogeenitBoorihappo valmistetaan pääasiassa booraksin mineraalin (natriumatriumtetraboraatin) reaktiolla mineraalihappojen, kuten suolahappo, rikkihappo, jne.
Naa2B -4JOMPIKUMPI9· 10H2O +hcl => 4 h3Bo3 + 2 NaCl +5 h2JOMPIKUMPI
Se valmistetaan myös boro- ja diborano trihaluron hydrolyysillä.
Boorihappo on valmistettu Collemanitista (CA2B -6JOMPIKUMPIyksitoista· 6 h2JOMPIKUMPI). Menettely koostuu mineraalin käsittelystä rikkihapolla boorikomilaation liuottamiseksi.
Sitten liuos, jossa on olemassa purkamattomien fragmenttien boorihappo, erotetaan. Rikkivetyliuos käsitellään arseenin ja raudan epäpuhtauksien saostamiseksi. Supernatantti on jäähdytetty tuottamaan saostumaa boorihappoa ja erottamaan se suspensiosta.
Sovellukset
Teollisuudessa
Boorihappoa käytetään lasikuitukehityksessä. Myötämällä sulamispisteen vähentäminen, se lisää tekstiilikuitujen lujuutta ja tehokkuutta: materiaali, jota käytetään aluksissa, teollisuusputkissa ja tietokonepiirilevyissä käytetyn muovin vahvistamiseen.
Boorihappo osallistuu borosiloidun lasin valmistukseen, joka mahdollistaa lasikestävän lasin saamisen, joka voidaan käyttää kotitalouskeittiöön, laboratorioiden lasimateriaaliin, fluoresoiviin putkiin, kuituoptisiin, LCD -näytöihin jne.
Sitä käytetään metallurgisessa teollisuudessa terässeosten kovettamiseen ja käsittelemiseen sekä materiaalien metallikierron suosimiseen.
Sitä käytetään kemiallisena komponenttina hydraulisessa murtumisessa (murtuminen): Öljyn ja kaasun uuttamisessa käytetty menetelmä. Pohjahappo toimii tulen hidastimena selluloosamateriaaleissa, muovissa ja tekstiileissä, jotka on kyllästetty boorihapolla palonkestävyyden lisäämiseksi.
Lääketieteellisesti
Boorihappoa käytetään laimennettuna silmien pesussa. Boorihappo -gelatiinikapseleita käytetään sieni -infektioiden, erityisesti Candida albicans -sovelluksen hoitoon. Sitä on käytetty myös aknen hoidossa.
Boorihappo on siroteltu sukkiin jalkojen infektioiden, kuten urheilijan jalka, estämiseksi. Samoin boorihappoa sisältäviä liuoksia käytetään ulkoisen otiitin hoidossa sekä eläimissä.
Pulloihin lisätään boorihappoa virtsan keräämiseen käytettyihin pulloihin, mikä estää bakteerikontaminaation ennen diagnostiikkalaboratorioiden tutkimista.
Se voi palvella sinua: indolaleetikkahappo: rakenne, ominaisuudet, hankkiminen, käyttöHyönteismyrkky
Boorihappoa käytetään hyönteisten lisääntymisen, kuten torakoiden, termiitien, muurahaisten, jne. Hallinnassa, jne. Torakat eivät tappaa heti, koska se vaikuttaa ensin sen ruuansulatukseen ja hermostoon, sen eksoskeletonin tuhoamisen lisäksi.
Boorihappo käyttää vaikutustaan hitaasti, jolloin hyönteiset ovat nieltyneet sen joutumaan kosketuksiin muiden hyönteisten kanssa, levittäen siten myrkytystä.
Säilyttäminen
Boorihappoa käytetään estämään puun hyökkäys sienten ja hyönteisten avulla, käyttämällä tätä tarkoitusta yhdessä etyleeniglykolin kanssa. Tämä hoito on tehokas myös liete- ja levien hallitsemiseksi.
PH -iskunvaimennin
Borinihappo ja sen konjugoitu emäs muodostavat PKA -vaimennusjärjestelmän = 9.24, mikä osoittaa, että tällä iskunvaimennuksella on suurin tehokkuus alkaliseen pH: han, jotka eivät ole tavallisia elävissä olennoissa. Borato -iskunvaimennin käytetään kuitenkin pH -säätelyssä uima -altaissa.
Ydinreaktorit
Boorihapolla on kyky kaapata lämpöneutroneja, mikä vähentää hallitsemattoman ydinfission mahdollisuutta, joka voi tuottaa ydinonnettomuuksia.
Maatalous
Boro on olennainen osa kasvien kasvua, joka indusoi boorihapon käytön elementin vaikutukseen. Ylimääräinen boorihappo voi kuitenkin vahingoittaa kasveja, erityisesti sitrushedelmiä.
Vasta -aiheet
Pohjaisen ihon, haavan tai polttotuotteen, joka mahdollistaa saman imeytymisen, on vältettävä boorihapon käyttöä. Tämä on myrkyllinen yhdiste kehon sisällä, ja joissain tapauksissa se voi aiheuttaa pyörtymistä, kouristuksia, kouristuksia, kasvojen tiikoita ja valtimoiden hypotensiota.
Lääkäriä tulisi kuulla boorihappojen emättimen kapselien käytöstä raskaana olevilla naisilla, koska on huomautettu, että sikiön muodonmuutokset ja lapsen kehon painon vähentyminen syntymän yhteydessä syntyessään.
Hyönteismyrkkynä käytettyjen boorihapon sijoittaminen lapsille, jotka ovat lasten saatavilla, koska lapsilla on suurempi alttius boorihapon myrkylliselle vaikutukselle, jolloin heihin muodostuu kohtalokas annos 2.000 - 3.000 mg.
Viitteet
- Shiver & Atkins. (2008). Epäorgaaninen kemia. (Neljäs painos). MC Graw Hill.
- Wikipedia. (2019). BOORIHAPPO. Haettu: vuonna.Wikipedia.org
- Kansallinen bioteknologiatietojen keskus. (2019). BOORIHAPPO. Pubchem -tietokanta. CID = 7628. Toipunut: Pubchem.NCBI.Nlm.NIH.Hallitus
- Enyclopaedia Britannica -toimittajat. (28. maaliskuuta 2019). BOORIHAPPO. Encyclopædia britannica. Toipunut: Britannica.com
- Kantaja värähtelevä. (9. marraskuuta 2018). Buriinihapon piilotetut USS: t jokapäiväisessä elämässäsi. Toipunut: Carriervibrationing.com
- Kansallinen torjunta -ainetietokeskus. (S.F.-A. BOORIHAPPO. Toipunut: NPIC.Orst.Edu
- Piirustus. (30. marraskuuta 2017). Boorihappo: Tämän kemiallisen yhdisteen ominaisuudet ja käytöt. Haettu: hapot.Tiedot
- Klorurosodium. (2019). Boorihappo. Toipunut: Chlorurosodium.com
- Espanjan sairaalan apteekki. (S.F.-A. Boorihappo. [PDF]. Haettu: työryhmät.Sefh.On
- « Optinen vertailu, mikä on käyttö ja osat
- 11 Kierrätyksen edut yhteiskunnassa (esimerkkien kanssa) »

