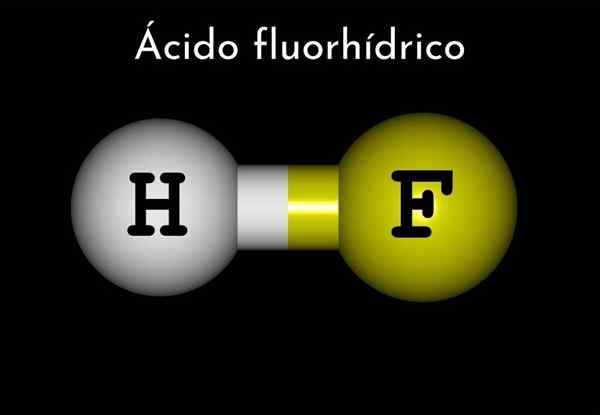
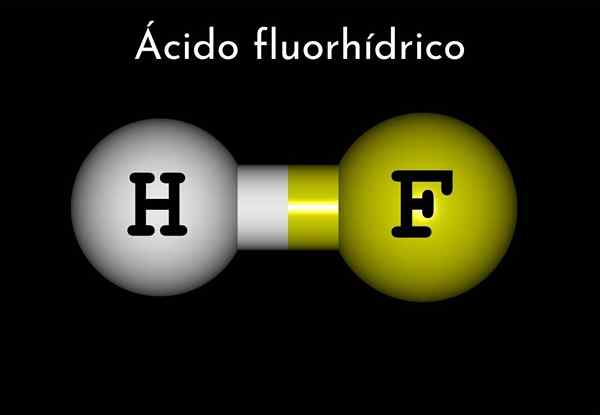
Fluoriahappo (HF)
- 1225
- 39
- Shawn Stanton II
Mikä on fluoriahappo?
Hän fluorivetyhappoa (HF)Se on vesiliuos, jossa vetyfluoridi liuenee. Tämä happo saadaan pääasiassa rikkihapon reaktiosta, joka on konsentroitu fluoriitti mineraalilla (CAF2-A. Mineraali hajoaa jäljellä olevan hapon vaikutuksella ja vesi liukenee vetyfluoridikaasut.
Samasta happamasta vedestä puhdas tuote voidaan tislata, toisin sanoen anhydridivetyfluoridi. Liuenneen kaasun määristä riippuen saadaan erilaisia pitoisuuksia ja siksi markkinoilla useita saatavilla.
Alle 40 %: n konsentraatiossa sillä on erottumaton kiteinen veden ulkonäkö, mutta korkeammissa pitoisuuksissa se sanoo hyvästit valkoisiin vetyfluoridihöyryihin. Fluoriahappoa tunnetaan yhtenä aggressiivisimmista ja vaarallisimmista kemikaaleista.
Se pystyy "syömään" melkein mitä tahansa materiaalia, johon sinulla on kosketus: lasista, keramiikasta ja metalleista, kiviin ja betoniin. Jossa säiliö tallennetaan sitten? Muovipulloissa inertit synteettiset polymeerit toimintaan.
Kaava
Vetyfluoridikaava on HF, mutta fluoriahappoa on esitetty vesipitoisessa väliaineessa, HF (AC), jotta se erotettaisiin ensimmäisestä.
Siten fluoriahappoa voidaan pitää hydraattivetyfluoridina, ja tämä on hapopiiri.
Rakenne fluorivetyhappoa
 3D -malli fluoriahapoista
3D -malli fluoriahapoista Kaikilla hapolla vedessä on kyky tuottaa ioneja tasapainoreaktiossa. Fluoridihapon tapauksessa on arvioitu, että liuoksessa on hionpari H3JOMPIKUMPI+ ja f-.
Anionin f- Luultavasti muodostavat erittäin vahvan vety-sillan, jossa on yksi kationista hydrogeneista (F-H-O+-H2-A. Tämä selittää, miksi fluoriarhorihappo on heikko Bree Aapt (protonien luovuttaja, H+) huolimatta siitä korkeasta ja vaarallisesta reaktiivisuudestaan; eli vedessä ei vapauta niin monta H+ Verrattuna muihin happoihin (HCl, HBR tai HI).
Se voi palvella sinua: kuinka monta asiakaselektronia hiilellä on?Vetyfluoridimolekyylien välissä konsentroituneissa fluoravihapon vuorovaikutuksissa ovat kuitenkin riittävän tehokkaita, jotta ne pääsevät paeta kaasufaasissa.
Toisin sanoen vedessä he voivat olla vuorovaikutuksessa ikään kuin ne olisivat nestemäisessä anhydridissä, muodostaen siten vety sillat näiden välillä. Nämä vety sillat voidaan rinnastaa melkein lineaarisiksi ketjuiksi (H-F-H-F-H-F-…), jota ympäröivät vedet.

Ylemmässä kuvassa linkin vastakkaiseen suuntaan suuntautuvien elektronien jakamattoman vääntömomentti (H-F :) on vuorovaikutuksessa toisen HF-molekyylin kanssa ketjun koottamiseksi.
Ominaisuudet fluorivetyhappoa
Koska se on vesiliuos fluoriarhorihappo. HF on hyvin liukoinen veteen ja on hygroskooppinen, kyky tuottaa erilaisia liuoksia: erittäin keskittyneistä (tupakoinnista ja keltaisten sävyjen kanssa) hyvin laimennettuihin.
Kun sen pitoisuus pienenee, HF (AC) omaksuu ominaisuudet, jotka ovat samanlaisia kuin puhdas vesi kuin anhydridi. H-F-H-vety sillat ovat kuitenkin vahvempia kuin vedessä, H2VOI VOI.
Molemmat ovat rinnakkain sopusoinnussa ratkaisuissa, nostamalla kiehumispisteitä (jopa 105ºC). Samoin tiheydet lisääntyvät, kun enemmän hinhydridiä liuentaan. Muista kaikilla HF (AC) -ratkaisuilla on vahvat ja ärsyttävät hajut ja ne ovat värittömiä.
Reaktiivisuus
Joten mikä on fluoriahapon syövyttävä käyttäytyminen? Vastaus on H-F-linkissä ja fluoriatomin kyvyssä muodostaa erittäin stabiilit kovalenttiset linkit.
Koska fluori on hyvin pieni ja elektronegatiivinen atomi, se on voimakas Lewis -happo. Toisin sanoen se erottuu vedystä yhdistääkseen lajit, jotka tarjoavat enemmän elektroneja alhaiseen energiakustannukseen. Esimerkiksi nämä lajit voivat olla metalleja, kuten lasissa olevaa piitä.
Se voi palvella sinua: ydinkemia: historia, opintokenttä, alueet, sovelluksetSitoa2 + 4 HF → SIF4(g) + 2 h2JOMPIKUMPI
Sitoa2 + 6 HF → H2SIF6 + 2 h2JOMPIKUMPI
Jos H-F-linkin dissosiaatioenergia on korkea (574 kJ/mol), miksi se rikkoo reaktioissa? Vastauksessa on kineettinen, rakenne- ja energian vivahteet. Yleensä mitä vähemmän reaktiivinen tuloksena oleva tuote, sitä suositumpi sen muodostuminen on.
Mitä tapahtuu f- vedessä? Fluoriahappojen konsentroituneissa liuoksissa toinen HF -molekyyli voi muodostaa vetysillan F: n kanssa- parista [h3JOMPIKUMPI+F--.
Tämä johtaa defluori -ionin luomiseen [FHF]-, joka on poikkeuksellisen hapan. Siksi kaikki fyysiset yhteydet tähän on erittäin haitallista. Pienin altistuminen voi laukaista viraston vaurioiden äärettömyyden.
Riittävän hallinnan kannalta on monia turvallisuusstandardeja ja -protokollia, ja siten vältetään mahdolliset onnettomuudet tämän hapon kanssa toimiville.
Käyttää/sovelluksia fluorhorhorihapon
Se on yhdiste, jolla on lukuisia sovelluksia teollisuudessa, tutkimuksessa ja kuluttajien työssä:
- Fluoriahappo tuottaa orgaanisia johdannaisia, jotka osallistuvat alumiinipuhdistusprosessiin.
- Sitä käytetään uraanin isotooppien erottamisessa, kuten uraanin heksafluoruron tapauksessa (UF6-A. Sitä käytetään myös metallien, kivien ja öljyjen uuttamisessa, käsittelyssä ja puhdistamisessa, jota käytetään myös muotin kasvun estämiseen ja muotin poistamiseen.
- Syövyttäviä happoominaisuuksia on käytetty kiteiden veistämiseen ja tallentamiseen, etenkin pakkasiin, etsaustekniikan avulla.
- Sitä käytetään silikonipemonductors -valmistuksessa, ja niiden kehittämisessä ja tietotekniikan kehittämisessä on useita käyttötarkoituksia, jotka vastaavat inhimillisestä kehityksestä.
- Sitä käytetään autoteollisuudessa siivoojana, jota käytetään muotinpoistoaineena keramiikassa.
- Joissakin ioninvaihtimissa käytetään välittäjänä välittäjänä joissakin kemiallisissa reaktioissa fluoriahappoa, joka osallistuu monimutkaisempien metallien ja aineiden puhdistamiseen.
- Osallistu öljynkäsittelyyn ja sen johdannaisiin, mikä on mahdollistanut liuottimien hankkimisen tuotteiden valmistuksessa rasvojen puhdistamiseen ja poistamiseen.
- Sitä käytetään viilun ja pintakäsittelyn aineiden muodostumisessa.
- Kuluttajat käyttävät lukuisia tuotteita, joissa fluoriahappo on osallistunut sen kehittämiseen; Esimerkiksi jotkut tarpeelliset autonhoitoon, huonekalujen puhdistustuotteisiin, sähkö- ja elektronisiin komponentteihin sekä polttoaineisiin, muun muassa.
Viitteet
- Pubchem. (2018). Fluorivetyhappoa. Haettu 3. huhtikuuta 2018, Lähettäjä: Pubchem.NCBI.Nlm.NIH.Hallitus.
- Kat -päivä. (16. huhtikuuta 2013). Happo, joka todella syö kaiken läpi. Haettu 3. huhtikuuta 2018, Lähettäjä: ChronicleFlask.com
- Wikipedia. (28. maaliskuuta 2018). Fluorivetyhappoa. Haettu 3. huhtikuuta 2018, osoitteesta:.Wikipedia.org.
- Shiver & Atkins. (2008). Epäorgaaninen kemia. (Neljäs painos., p. 129, 207-249, 349, 407). MC Graw Hill.
- Fluorivetyhappoa. Kansan-. Etelä -Carolinan lääketieteellinen yliopisto. Haettu 3. huhtikuuta 2018: AcademicDePartments.Kansan-.Edu