Fosforihappo (H3PO3)
- 4492
- 1219
- Sheldon Kuhn
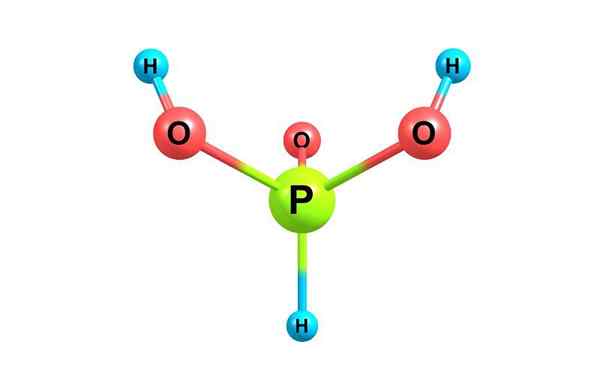
 Fosforihapon kemiallinen rakenne. Lisenssillä
Fosforihapon kemiallinen rakenne. Lisenssillä Mikä on fosforihappo?
Hän fosforihappo, Kutsutaan myös ortofosfatiivihapoksi, se on kaavan H kemiallinen yhdiste3Poikki3. Se on yksi fosforin erilaisista hapettuneista hapoista ja sen rakenne on esitetty ylemmässä kuvassa.
Yhdistetyn kaavan vuoksi tämä voidaan kirjoittaa uudelleen HPO: na (OH)2. Tämä laji on tasapainossa pienen tautomerin P (OH) kanssa3.
IUPAC: n, 2005, suositukset ovat, että jälkimmäistä kutsutaan fosforihapoksi, kun taas dihydroksimuotoa kutsutaan fosfonihapoksi. Vain vähentyneet fosforiyhdisteet ovat loitsuja, joissa on "karhu" pääte.
Fosforihappo on diproottinen happo, tämä tarkoittaa, että sillä on vain kyky tuottaa kaksi protonia. Tämä johtuu siitä, että suurin osa tautomeerista on h3Poikki3.
Kun tämä muoto menettää protonin, resonanssi stabiloi muodostetut anionit. P (OH) TautoMero 3: lla ei ole hyötyä resonanssin vakauttamisesta. Tämä tekee kolmannen protonin poistamisesta paljon vaikeamman.
Fosforihappo (H3Poikki3) Myynti, jota kutsutaan fosfiiteiksi, joita käytetään vähentävinä aineina. Se valmistetaan liuottamalla tetrafosforinen heksaksidi (P4JOMPIKUMPI6) Yhtälön mukaan:
P4JOMPIKUMPI6 + 6 H₂O → 4 HPO (OH)2
Puhdas fosforihappo, H3Poikki3, Se on paremmin valmistettu fosforitrikloridihydrolyysillä, PCL3.
PCL3 + 3H2O → HPO (OH)2 + 3HCL
Tuloksena oleva liuos lämmitetään HCL: n karkottamiseksi, ja jäljellä oleva vesi haihtuu, kunnes se ilmestyy 3Poikki3 kiteinen värikäs jäähdytettäessä. Happo voidaan saada myös veden vaikutuksella PBR: ään3 tai pi3.
Fysikaaliset ja kemialliset ominaisuudet fosforihappo
- Fosforihappo on valkoinen tai keltainen hygroskooppinen tetraedrinen kide, aromi, joka on samanlainen kuin valkosipuli.
Voi palvella sinua: tyydyttymätön ratkaisu- H3Poikki3 Sen molekyylipaino on 82,0 g/mol ja tiheys 1 651 g/ml.
- Yhdisteessä on 73 ° C: n sulamispiste ja hajoaa yli 200 ° C.
- Se liukenee veteen, pystyy liuottamaan 310 grammaa 100 ml tätä liuotinta. Se liukenee myös etanoliin.
- Se on vahva happo, jonka PKA on 1,3 - 1,6.
- Fosforihapon kuumentaminen noin 200 ° C: ssa tekee siitä suhteettoman fosforihapon ja fosfiinin (pH3-A. Fosfiini on kaasu, joka yleensä kytkeytyy spontaanisti ilmassa.
4H3Poikki3 + Lämpö → pH3 + 3H3Poikki4
Reaktiivisuus ja vaarat
Reaktiivisuus
- Fosforihappo ei ole stabiili yhdiste.
- Absorboi ilman happi fosforihappojen muodostamiseksi.
- Muodosta keltaisia kerrostumia vesiliuoksessa, jotka ovat spontaanisti syttyviä kuivattaessa.
- Reagoi eksotermisesti kemiallisten emäksien kanssa (esimerkiksi: epäorgaaniset amiinit ja hydroksidit) suolojen muodostamiseksi.
- Nämä reaktiot voivat tuottaa vaarallisesti suuria määriä lämpöä pienissä tiloissa.
- Veden liukeneminen tai väkevä liuoksen laimennus lisävedellä voi tuottaa merkittävää lämpöä.
- Reagoi kosteuden läsnä ollessa aktiivisten metallien kanssa, mukaan lukien rakenteelliset metallit, kuten alumiini ja rauta, vedyn vapauttamiseksi, palava kaasu.
- Voit aloittaa tiettyjen alkeenien polymeroinnin. Reagoi syanidiyhdisteiden kanssa kaasumaisen vedyn syanidin vapauttamiseksi.
- Se voi tuottaa syttyviä ja / tai myrkyllisiä kaasuja kosketuksessa ditiokarbamaattien, isokianaattien, kauppiaiden, nitridien, nitriilien, sulfidien ja voimakkaiden pelkistävien aineiden kanssa.
- Lisäkaasua tuottavia reaktioita tuotetaan sulfiiteilla, nitriitteillä, tiosulfaateilla (H2S: n ja SO3: n antamiseksi), dionitos (SO2: n ja karbonaattien antamiseksi (co₂: n antamiseksi).
Se voi palvella sinua: einstenio (t): rakenne, ominaisuudet, hankkiminen, käyttöVaarat
- Yhdiste on syövyttävä silmille ja iholle.
- Silmäkosketus voi johtaa sarveiskalvon vaurioihin tai sokeuteen.
- Ihon kosketus voi tuottaa tulehduksia ja rakkuloita.
- Pölyn hengittäminen aiheuttaa maha -suolikanavan tai hengitysteiden ärsytystä, jolle on ominaista polttaminen, aivastelu ja yskä.
- Vakava liiallinen altistuminen voi aiheuttaa keuhkovaurioita, tukehtumista, tiedon menetystä tai kuolemaa.
Toimenpiteet vaurioiden tapauksessa
- Varmista, että lääketieteellinen henkilökunta on tietoinen mukana olevista materiaaleista ja ryhdyt varotoimenpiteisiin suojelemiseksi.
- Uhri on siirrettävä uudelle alueelle ja soita hätäpalvelulle.
- Keinotekoinen hengitys tulisi antaa, jos uhri ei hengitä.
- Suu -suuhun menetelmää ei tule käyttää, jos uhri on nielty tai hengittänyt aineen.
- Keinotekoinen hengitys suoritetaan yksisuuntaisella venttiilillä varustetun taskunaamion avulla tai muulla riittävällä hengityslaitteella.
- Happea tulisi antaa, jos hengitys on vaikeaa.
- Saastuneet vaatteet ja kengät on poistettava ja eristettävä.
- Jos sinulla on kosketus aineen kanssa, huuhtele iho tai silmät heti juoksevalla vedellä vähintään 20 minuutin ajan.
- Alemman ihon kosketuksessa materiaalia tulisi välttää käyttämättä olevalla iholla.
- Pidä uhri rauhallisena ja kuumana.
- Altistumisen vaikutukset (hengitys, nauttiminen tai ihon kosketus) voivat viivästyä.
Käyttö fosforihappo
- Fosforihapon tärkein käyttö on vedenkäsittelyssä käytettyjen fosfilmien tuotanto. Fosforihappoa käytetään myös fosfiittisuolojen, kuten kaliumfosfiinin, valmistamiseen.
Voi palvella sinua: Boyle Law- Fosfiitit ovat osoittaneet tehokkuutta monien kasvien hallinnassa.
- Erityisesti tavaratilan tai lehtien injektointikäsittely, joka sisältää fosforihapon suoloja, on osoitettu vasteena fytofteran ja pythium -tyypin kasvien patogeeneistä johtuen (tuottaa juuren hajoamisen).
- Fosforihappoa ja fosfiteja käytetään pelkistävinä aineina kemiallisessa analyysissä. Mandelihappojodidilla katalysoimalla fenyyliakesikkahapojen uusi kätevä ja skaalautuva synteesi perustuu jodidekekappahapon in -Sitterin muodostumiseen katalyyttisestä natriumjodidista. Tätä varten fosforihappoa käytetään stökiometrisenä pelkistimenä.
- Sitä käytetään ainesosana POLI -teollisuudessa käytettyjen lisäaineiden tuotantoon (vinyylikloridi). Myös fosforihapon estereitä käytetään useissa orgaanisen synteesin reaktioissa.
Viitteet
- Fosforihappo (H3PO3). Toipunut Britannicasta.com.
- Mushonihappo. Toipunut EBI: stä.Ac.Yhdistynyt kuningaskunta.

