Fosforihappo (H3PO4)
- 4081
- 1143
- Juan Breitenberg V
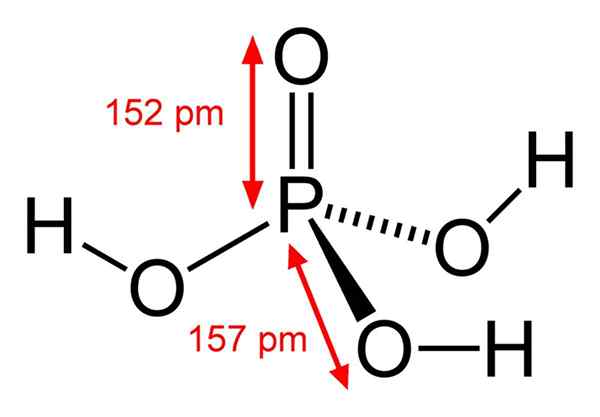
 Yksittäinen fosforihappomolekyyli
Yksittäinen fosforihappomolekyyli Mikä on fosforihappo?
Hän fosforihappo Se on fosforin happo, jolla on kemiallinen kaava H3Poikki4. Se koostuu mineraalihaposta, jossa kolme happoa protonia on kytketty fosfaatti -anioniin (Po43--A. Vaikka sitä ei pidetä vahvana happona, sen sopimattomalla käytöllä voi olla terveysriski.
Sitä löytyy kahdesta tilasta: kiinteänä kiinteänä ortorromisten kiteiden muodossa tai kiteisenä siirappin näköisellä nesteinä. Sen tavanomaisimman kaupallisen esityksen pitoisuus on 85% P/P ja tiheys 1 685 g/cm3. Tämä tiheys tulee keskittymisen kädestä.
Kolme OH -ryhmää on vastuussa happohyvyn luovuttamisesta. Niiden läsnäolon vuoksi niiden rakenteessa voit reagoida erilaisten hydroksidien kanssa, jotka aiheuttavat useita suoloja.
Natriumhydroksidin tapauksessa voit muodostaa kolme: monobasinen natriumfosfaatti (NAH2Poikki4), Dibasinen natriumfosfaatti (NA2HPO4) ja heimojen natriumfosfaatti (NA3Poikki4-A.
Kuitenkin riippuen siitä, mitä emästä käytetään neutralointiin tai mitkä kationit ovat hyvin lähellä sitä, voit muodostaa muita fosfaattisuoloja. Niiden joukossa ovat: kalsiumfosfaatti (CA3(PO4-A2), Litiumfosfaatti (Li3Poikki4), ferrifosfaatti (FEPO4), ja muut. Jokaisella on fosfaatti -anionin eri protonointiasteet.
Toisaalta fosforihappo voi "siepata" kalliita kationien, kuten usko2+, Cu2+, Ac2+ ja mg2+. Korkeissa lämpötiloissa voit reagoida itsesi kanssa H -molekyylin menetyksellä2Tai fosforihappojen halkaisijat, trimmeri ja polymeerit.
Tämän tyyppinen reaktio tekee tästä yhdistyksestä kykenevän määräämään suuren määrän rakenteita fosforin ja hapen luurankojen kanssa, joista saadaan myös laaja valikoima tunnettuja suoloja, kuten polyfosfaatit, kuten polyfosfaatit.
Hänen löytönsä suhteen hänet syntetisoi vuonna 1694 Robert Boyle (1627-1691), liuottaen p2JOMPIKUMPI5 (Fosforipentoksidi) vedessä. Se on yksi hyödyllisimmistä mineraalihapoista, mikä on sen toiminta lannoitteena tärkeimpiä.
Fosfori, kalium ja typpi muodostavat kasvien kolme pääravintoainetta.
Kemiallinen fosforihapon rakenne
 Kemiallinen fosforihapon rakenne
Kemiallinen fosforihapon rakenne Fosforihappo koostuu p = o -sidoksesta. Kun fosforiatomi keskellä, happi piirtää eräänlaisen molekyylin tetraedron.
Tällä tavalla fosforihappo voidaan visualisoida tetraedrina. Tästä näkökulmasta nämä tetraedrat (H -yksiköt3Poikki4) vuorovaikutuksessa toistensa kanssa vety silloilla; toisin sanoen heidän kärkipisteet lähestyvät tarkasti.
Nämä molekyylien väliset vuorovaikutukset mahdollistavat fosforihapon kiteisen kahdessa kiinteässä aineessa: vedettömät ja hemihydraatit (H3Poikki4· 1/2H2O), molemmat monokliinisillä kiteisillä järjestelmillä. Sen anhydra -muoto voidaan kuvata myös kaavalla: 3H2Tai · p2JOMPIKUMPI5, joka on yhtä suuri kuin tri-hydratoitu fosforipentoksidi.
Tetrahedra voi jopa yhdistää kovalenttisesti, mutta tämän yksiköiden on poistettava vesimolekyyli kuivumisen kautta. Tämä tapahtuu, kun h3Poikki4 Se lämmittää lämmitystä ja tuottaa seurauksena polyfosfääristen happojen muodostumisen (PA).
Dipofosforihappo (H4P2JOMPIKUMPI7-A
Yksinkertaisin kaikista PA: sta on diposforiinihappo (H4P2JOMPIKUMPI7), tunnetaan myös nimellä pyrofosforihappo. Muodostumasi kemiallinen yhtälö on seuraava:
Se voi palvella sinua: alumiinifosfaatti (ALPO4): rakenne, ominaisuudet, hankkiminen, käyttö2H3Poikki4 H4P2JOMPIKUMPI7 + H2JOMPIKUMPI
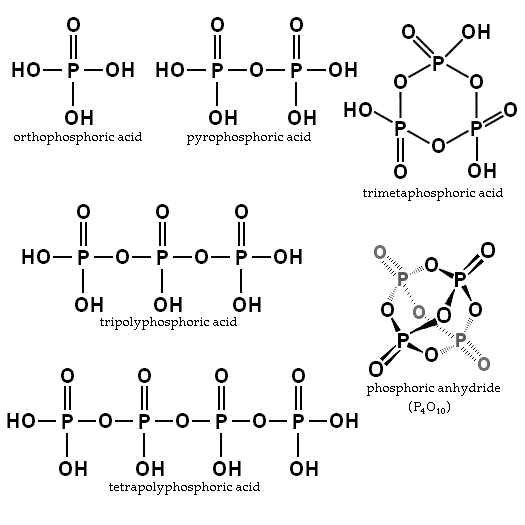
Tasapaino riippuu veden ja lämpötilan määrästä. Mikä on sen rakenne? Ortofosfahin ja pyrofosforihapon rakenteet havainnollistetaan osion kuvassa vasemmassa yläkulmassa.
Kaksi yksikköä liittyy kovalenttisesti, kun vesimolekyyli poistetaan, muodostaen P-O-P-happisilta niiden välillä. Nyt ne eivät ole kolme happoa vetyä, vaan neljä (neljä ryhmää -OH). Tämän vuoksi h4P2JOMPIKUMPI7 esittelee neljä k vakiota k-lla.
Polyfosforihapot
Dehydraatio voi jatkua pyrofosforihapolla, jos lämmitys jatkuu. Koska? Koska sen molekyylin molemmissa päissä on OH-ryhmä, joka voidaan eliminoida vesimolekyylinä, mikä edistää p-o-o-o-p-luurankoa seuraavaa kasvua ... p ..
Esimerkkejä näistä hapoista ovat trimfosfori- ja tetropolifforihapot (molemmat havainnollistettu myös edellisessä kuvassa). Voidaan nähdä, kuinka p-o-p-luuranko pidentyy eräänlaisessa ketjussa, jonka muodostaa tetraedran.
Nämä yhdisteet voidaan edustaa HO -kaavalla (PO2VAI NIIN)xH, missä Ho on vasen pää, joka voi kuivuttaa. Poikki2Voi on fosforirunko p = o: n ja OH -linkkien kanssa; Ja x ovat fosforihappoyksiköitä tai molekyylejä, jotka ovat tarpeen mainitun ketjun saamiseksi.
Kun nämä yhdisteet neutraloidaan kokonaan, niin ns. Polyfosfaatit ovat peräisin. Kationien ympäröimistä kationeista riippuen ne muodostavat monenlaisia polyfosfaattisuoloja.
Toisaalta, jos he reagoivat ROH -alkoholien kanssa, niiden luurankon hydrogens korvataan alkyylisubstituenteilla r-. Siten syntyy fosfaattiestereitä (tai polyfyse): Ro (PO2Tai)xR -. Riittää korvaamaan H r: n kaikki osan kuvan rakenteet niiden hankkimiseksi.
Sykliset polyfosforihapot
P-O-P-ketjut voidaan jopa sulkea renkaassa tai fosforisyklissä. Tämän tyyppisen yhdisteen yksinkertaisin on trimetafosforihappo (kuvan oikea yläkulma). Siten PA: t voivat olla lineaarisia, syklisiä; tai jos niiden rakenteet osoittavat molemmat tyypit, haarautuneet.
Nimikkeistö
 Fosforihappo. Lähde: Commons.Wikimedia.org
Fosforihappo. Lähde: Commons.Wikimedia.org Fosforihapon nimikkeistöä hallitsee IUPAC ja kuinka oksoasidien nukulansuolat on nimetty.
Koska H: ssä3Poikki4 P: n atomilla on Valencia +5, joka on suurin arvo, sen hapolle annetaan jälkiliite -ico fosfori -etuliitteelle-.
Orto-
Fosforihappo on kuitenkin myös yleensä myös ortofosforihappo. Koska? Koska sana 'orto' on kreikkalainen ja tarkoittaa 'totta'; mikä johtaisi "tosi muoto" tai "nesteytyneemmälle".
Kun fosfori -anhydro hydratoidaan ylimääräisellä vedellä (P4JOMPIKUMPI10, "Ylivoimainen kuva" korkki ")3Poikki4 (3H2Tai · p2JOMPIKUMPI5-A. Siten Ortho -etuliite myönnetään niille hapoille, jotka on muodostettu runsaalla vedellä.
Piro-
Piro-etuliite viittaa jokaiseen yhdisteeseen, joka on peräisin lämmön levittämisen jälkeen, koska diposforihappo syntyy fosforihapon lämpö kuivumisesta. Siksi sitä kutsutaan pyrofosforihapona (2H 2H2Tai · p2JOMPIKUMPI5-A.
Päämäärä-
Kohde -etuliite, joka on myös kreikkalainen sana, tarkoittaa 'jälkeen'. Se lisätään niihin aineisiin, joiden kaava on eliminoinut molekyylin, tässä tapauksessa vesi:
H3Poikki4 => HPO3 + H2JOMPIKUMPI
Huomaa, että tällä kertaa kahden fosfori -yksikön lisääminen ei tapahdu diposfaasihapon muodostamiseksi, vaan saadaan metafosforihapon sijasta (josta sen olemassaolosta ei ole näyttöä).
Voi palvella sinua: etyylialkoholi: rakenne, ominaisuudet, käyttötarkoitukset, hankkiminenOn myös tärkeää korostaa, että tätä happoa voidaan kuvata h2Tai · p2JOMPIKUMPI5 (Samanlainen kuin hemidraatti, kertomalla HPO3 2). Etuliitteen meta-meta- on täydellisesti syklisen PAS: n mukaan, koska jos trfosforihappo kuivuu, mutta se ei lisää toista yksikköä H3Poikki4 Tetrafosforihapon tulemiseksi sinun on muodostettava rengas.
Ja tämä on sama muiden polymeetofosforihapon kanssa, vaikka IUPAC suosittelee kutsumaan niitä vastaavien PAS: n syklisiksi yhdisteiksi.
Fosforihapon ominaisuudet
Molekyylikaava
H3Poikki4
Molekyylipaino
97 994 g/mol
Fyysinen ulkonäkö
Kiinteässä muodossaan se esittelee ortorromisia, hygroskooppisia ja läpinäkyviä kiteitä. Nestemäisessä muodossa se on kiteistä, viskoosisella siirappin ulkonäöllä.
Kaupallisesti se saavutetaan vesiliuoksessa, jonka konsentraatio on 85% P/P. Kaikissa näissä esityksissä sillä ei ole hajua.
Kiehumis- ja fuusiopisteet
158º C (316º F 760 mmHg).
108º F (42,2º C).
Vesiliukoisuus
548 g/100 g h2Tai 20º C; 369,4 g/100 ml 0,5º C; 446 g/100m nopeudella 14,95º C.
Tiheys
1 892 g/cm3 (kiinteä); 1,841 g/cm3 (100%liuosta); 1 685 g/cm3 (85%liuos); 1 334 g/cm3 50%liuosta) 25ºC: n lämpötilassa.
Höyrytiheys
Ilman suhteellinen 3,4 (ilma = 1).
Itset sytytys
Se ei ole syttyvä.
Goo
3,86 Mpoise (40% - 20º C).
Happamuus
PH: 1,5 (0,1 N liuos vedessä)
PKA: PKA1 = 2 148; PKA2 = 7,198 ja PKA3 = 12,319. Siksi sen happea vety on ensimmäinen.
Hajoaminen
Kun hän on lämmitetty, hän vapauttaa fosforioksidit. Jos lämpötila nousee arvoon 213º C tai enemmän, siitä tulee pyrofosforihappo (H4P2JOMPIKUMPI7-A.
Syövyttävyys
Syövyttävä rautametalleille ja alumiinille. Kun reagoivat näiden metallien kanssa, vety palava kaasu on peräisin.
Polymerointi
Väkivaltaisesti polymeriza huijausyhdisteillä, epoksideilla ja polymeroivissa yhdisteillä.
Fosforihappo käyttää
Fosphat ja yleinen käyttö käyttää myyntiä
-Fosforihappo toimii fosfaatin yksityiskohtien perustana, jota käytetään lannoitteina, koska fosfori on kasvien pääravinteita.
-Sitä on käytetty johtavien myrkytysten ja muiden tilojen hoidossa, joissa tarvitaan tärkeitä fosfaattimääriä ja lievän asidoosin tuotantoa.
-Sitä käytetään minkkien ja kissojen virtsateiden pH: n hallintaan munuaislaskelmien muodostumisen välttämiseksi.
-Fosforihappo aiheuttaa NA -suoloja2HPO4 ja nah2Poikki4 jotka muodostavat pH -iskunvaimenninjärjestelmän, jonka PKA on 6,8. Tätä pH -säätelyjärjestelmää on läsnä ihmisillä, joilla on merkitys solunsisäisen pH: n säätelyssä, samoin kuin vetypitoisuuden hallinnassa nefronien distaalisissa ja keräinputkissa.
-Sitä käytetään tähän metalliin kerääntyvän mohosa -kerroksen eliminoinnissa. Fosforihappo muodostaa rautafosfaatin, joka voidaan helposti poistaa metallipinnasta. Sitä käytetään myös alumiinin sähkökielessä.
Teollisuuden edustajat
-Fosforihappo on tarkoitettu katalyyttiseksi aineeksi nylonin ja bensiinin kehittämisessä. Sitä käytetään kuivausaineena litografisessa kaiverruksessa, väriaineiden laatimisessa käytettäväksi tekstiiliteollisuudessa, lateksin hyytymisprosessissa rannikkoteollisuudessa ja vetyperoksidin (vetyperoksidi (vetyperoksidi) puhdistamisessa (vetyperoksidi) (vetyperoksidi) puhdistamisessa (vetyperoksidi) (vetyperoksidi).
-Happoa käytetään lisäaineena virvoitusjuomissa, jotka vaikuttavat tällä tavalla sen makuun. Laimennettu, sitä levitetään sokerin hienosäätöprosessissa. Se toimii myös iskunvaimenninjärjestelmänä kinkun, gelatiinin ja antibioottien valmistuksessa.
Voi palvella sinua: Alumiinihydroksidi: rakenne, ominaisuudet, käytöt, riskit-Puuttuvat pesuaineiden kehittämiseen asetyleenituotannon happakatalyysiin.
-Sitä käytetään happona tasapainoisissa elintarvikkeissa karjateollisuudelle ja lemmikkieläimille. Lääketeollisuus käyttää sitä antiemetien lääkkeiden valmistuksessa. Se hyödyntää myös seosta asfaltin valmistamiseksi maan tasoittamiseksi ja halkeamien korjaamiseksi.
-Fosforihappo toimii katalyyttinä alkeenien hydraatioreaktiossa alkoholin, lähinnä etanolin tuottamiseksi. Lisäksi sitä käytetään orgaanisen hiilen määrittämiseen maaperässä.
Hammaslääketieteellinen
Hammaslääkärit käyttävät sitä hammaspinnan puhdistamiseen ja kunnostamiseen ennen hammaslääketieteellisten tukien sijoittamista. Se löytää myös käyttöä hammasvalkaisussa ja hammaslevyjen eliminoinnissa. Lisäksi sitä käytetään liiman valmistuksessa hammasproteeseille.
Kosmetiikka
Fosforihappoa käytetään säätämään pH: ta kosmeettisten tuotteiden kehittämisessä ja ihonhoitoon. Sitä käytetään kemiallisena hapettavan aineena aktivoidun hiilen tuotannossa.
Fosforihapon muodostuminen
-Fosforihappo valmistetaan apatiittityyppisistä fosfaattikivistä sen konsentroituneiden rikkihappojen sulamisen avulla:
Ac3(PO4-A2 + 3 h2Sw4 + 6 h2O => 2 h3Poikki4 + 3 (tapaus4.2H2JOMPIKUMPI)
Tässä reaktiossa saatu fosforihappo on alhainen puhtaus, joten se käy läpi puhdistusprosessin, joka sisältää saostumisen, liuotinuution, kiteytymisen ja ioninvaihtotekniikat.
-Fosforihappo voi tapahtua liukenemalla fosforipentoksidia kiehuvaan veteen.
-Se voidaan saada myös kuumentamalla fosforia ilman ja vesihöyryn seoksella:
P4 (l) +5 o2 (g) => p4JOMPIKUMPI10 (S)
P4JOMPIKUMPI10 (s) +h2Tai (g) => 4H3Poikki4 (L)
Riskejä
-Koska höyrynpaine on alhainen huoneenlämpötilassa, on epätodennäköistä, että höyryt voidaan hengittää, ellei happo suihkuteta. Jos niin, heidän hengityksen oireisiin kuuluvat: yskä, kurkkukipu, lyhyt ja työläs hengitys.
-Kirjallisuudessa mainitaan merimiehen tapaus, joka oli altistunut fosforihappuhöyryille pitkän ajanjakson ajan. Kärsi yleisestä heikkoudesta, kuivasta yskästä, rintakipuista ja hengitysvaikeuksista. Vuoden kuluttua näyttelyn jälkeen havaittiin reaktiivinen toimintahäiriö.
-Ihon kosketus fosforihapon kanssa voi aiheuttaa punoitusta, kipua, rakkuloita ja ihon palovammoja.
-Hapon kosketus silmiin riippuen sen pitoisuudesta ja kosketuksen kestosta riippuen näissä kudoksen syövyttävät vauriot tai vakavat palovammat pysyvällä silmävauriolla.
-Hapon nauttiminen aiheuttaa suussa ja kurkkuun palaneen, ardorin tunne rintalastan ulkopuolella, vatsakipu, oksentelu, shokki ja romahtaminen.
Viitteet
- Kuninkaallinen kemian yhdistys. (2015). Fosforihappo. Otettu: Chemspider.com
- Kanadan terveys- ja työturvallisuuskeskus. (1999). Fosforihappo - terveysvaikutukset. Otettu: ccsso.Ac
- Hapot.Tiedot. (2018). Fosforihappo "Tämän kemiallisen yhdisteen käyttötarkoitukset. Otettu: hapot.Tiedot
- James P. Smith, Walter E. Brown ja James R. Leht. (1955). Kiteisen fosforihapon rakenne. J -. OLEN. Kemia. Soc. 77, 10, 2728-2730
- Wikipedia. (2018). Fosforihapot ja fosfaatit. Otettu: sisään.Wikipedia.org
- Tiede on hauskaa. Opi fosforihaposta. [PDF]. Otettu: Scifun.Kemia.WISC.Edu

