Vahva happo
- 4723
- 1162
- Gustavo Runte DVM
 Vahva happo on happo, joka on täysin dissosioitunut vakiopaine- ja lämpötilaliuoksessa
Vahva happo on happo, joka on täysin dissosioitunut vakiopaine- ja lämpötilaliuoksessa Mikä on vahva happo?
Eräs vahva happo Se on mikä tahansa yhdiste, joka kykenee vapauttamaan ja peruuttamattomasti protoneja tai vety -ioneja, H+. Koska suuri määrä lajeja on niin reaktiivinen, on pakko hyväksyä nämä H+, kuten vesi, jonka seosta tulee potentiaalisesti vaarallinen yksinkertaisella fyysisellä kosketuksella.
Happo luovuttaa veteen protonin, joka toimii perustana hydrium -ionin, H3JOMPIKUMPI+. Hydroniumionipitoisuus voimakkaan hapon liuoksessa on yhtä suuri kuin happopitoisuus ([H3JOMPIKUMPI+] = [HAC]).
Mitä korkeampi hapon pitoisuus (heikko tai vahva), sen on oltava varovaisempi manipuloinnissa. Siksi suolahapon pullot, typpihappopullot osoittavat kuvan, joka satuttaa käsiä, jotka satuttavat siihen.
Vahvat hapot ovat aineita, joita on manipuloitava täydellä tietoisuudella niiden mahdollisista vaikutuksista. Heidän kanssaan työskenteleminen voi hyödyntää niiden ominaisuuksiaan monikäyttöön, koska se on yksi yleisimmistä näytteenoton synteesistä tai keinoista.
Vahvan hapon ominaisuudet
Dissosiaatio
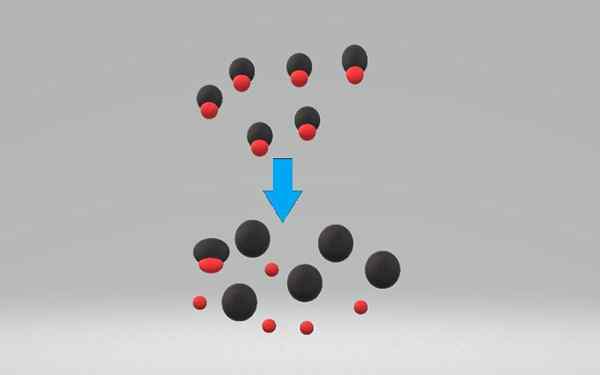
Vahva happo dissosioituu tai ioniza 100%: ssa vesiliuoksessa, hyväksymällä pari elektronia. Hapon dissosiaatio voi kaataa seuraavan kemiallisen yhtälön kanssa:
Hac +h₂o => a- + H3JOMPIKUMPI+
Missä on vahvaa happoa ja- Konjugoitu pohja.
Vahvan hapon ionisaatio on prosessi, joka on yleensä peruuttamaton. Heikissä hapoissa, päinvastoin, ionisaatio on palautuvaa. Yhtälö osoittaa, että H₂o on se, joka hyväksyy protonin, mutta myös alkoholit ja muut liuottimet voivat tehdä niin.
Voi palvella sinua: kuiva akkuTämä taipumus hyväksyä protoneja vaihtelee aineesta toiseen, ja siten HAC: n happama voima ei ole sama kaikissa liuottimissa.
PHE
Vahvan hapon pH on hyvin pieni, koska se on välillä 0 - 1 pH -yksikköä. Esimerkiksi HCL 0 -ratkaisu.1 m: n pH on 1.
Tämä voidaan osoittaa käyttämällä kaavaa
ph = - log [h+-
Voit laskea HCl 0 -liuoksen pH: n.1 m, sitten levitetään
ph = -log (0.1)
PH: n saaminen 1 HCL 0 -liuokselle.1 m.
Pka
Happojen vahvuus liittyy heidän PKA: hon. Hydrium -ioni (H3JOMPIKUMPI+) Esimerkiksi PKA on -1.74. Yleensä vahvoilla hapolla on PKA, jolla on enemmän negatiivisia arvoja kuin -1.74, ja ovat siksi enemmän happoja kuin itse3JOMPIKUMPI+.
PKA ekspressoi tietyllä tavalla hapon trendin dissosioitumiseen. Mitä alhaisempi sen arvo, sitä kovempi ja aggressiivisin on happo. Tästä syystä on kätevää ilmaista hapon suhteellinen lujuus PKA: n arvon kautta.
Korroosio
Yleensä vahvat hapot on luetteloitu syövyttäviksi. Tälle oletukselle on kuitenkin poikkeuksia.
Esimerkiksi fluoriarkeaa happo on heikko happo, ja silti se on erittäin syövyttävä ja kykenevä liuottamaan lasia. Tämän vuoksi sinun on manipuloitava muovipulloissa ja matalissa lämpötiloissa.
Päinvastoin, suuren lujuuden happo, kuten hiili -superhappo, joka on miljoonia kertoja voimakkaampia kuin rikkihappo, ei ole syövyttävää.
Tekijät, jotka vaikuttavat vahvaan happoon
Sen konjugoidun pohjan elektronegatiivisuus
Kun oikea siirtymä tapahtuu jaksollisella taulukon ajanjaksolla, konjugoituneen emäksen muodostavien elementtien negatiivisuus kasvaa.
Voi palvella sinua: Adsorptio -isotermit: konsepti, tyypit, esimerkitJaksollisen taulukon ajanjakson 3 havainto osoittaa esimerkiksi, että kloori on enemmän elektronegatiivista kuin rikki ja puolestaan rikki on enemmän elektronegatiivista kuin fosforia.
Tämä on yhtä mieltä siitä, että suolahappo on voimakkaampi kuin rikkihappo, ja jälkimmäinen on vahvempi kuin fosforihappo.
Lisäämällä hapon konjugaattipohjan elektronegatiivisuutta, se lisää emäksen stabiilisuutta ja vähentää siksi sen taipumusta uudelleen ryhmittymiseen vedyn kanssa hapon uudistamiseksi.
Muita tekijöitä tulisi kuitenkin harkita, koska tämä ei ole ratkaiseva yksin.
Konjugaatti perusradio
Happovoima riippuu myös sen konjugoidun emäksen säteesta. Ryhmä VIIA: n säännöllinen taulukon (halogenos) havainto osoittaa, että ryhmän muodostavien elementtien atomiradiot pitävät seuraavan suhteen: i> br> cl> f.
Samoin hapot pitävät saman vähenevän happojen voiman järjestyksen:
Hei> hbr> hcl> hf
Yhteenvetona voidaan todeta, että lisäämällä saman ryhmän elementtien atomisäde jaksollisessa taulukossa, niiden muodostaman hapon voima kasvaa samassa mielessä.
Tämä selitetään H-AC-linkin heikkenemisessä epätasa-arvoisten atomien kiertoratojen huonolla päällekkäisyyksillä.
Happiatomien lukumäärä
Hapon voima oksasidien sarjassa riippuu happiatomien lukumäärästä, joilla on konjugoitu emäs.
Voi palvella sinua: 10 esimerkkiä ei -polaarisista kovalenttisia linkkejäMolekyylit, joilla on eniten happiatomeja. Esimerkiksi typpihappo (HNO3) Se on vahvempi happo kuin typpihappo (HNO2-A.
Toisaalta perklorihappo (HCLO4) on vahvempi happo kuin kloorihappo (HCLO3-A. Ja lopuksi, hypokloorihappo (HCLO) on sarjan alemman lujuushappo.
Esimerkkejä vahvoista hapoista
- Yodhydric -happo (HI)
- Bromhydric -happo (HBR)
- Perkloorihappo (HCLO4-A
- Suolahappo (HCL)
- Rikkihappo (H2Sw4-A
- P-toluenosulfonihappo (CHO3C6H4Sw3H)
- Typpihappo (HNO3-A
- Bromihappo (hbro3-A
- Yodiumihappo (HIO3-A
- Kloorihappo (HCLO3-A
- Typpihappo (HNO2-A
- Fluoroantimonihappo (H [SBF6-
- Fluorosulfonihappo (FSO3H)
- Trifluorimetanosulfonihappo (vrt3Sw3H)
- Taikahappo (FSO3HSBF5-A
Viitteet
- Ominaisuudet, jotka määrittävät happolujuuden. Shmoopista toipunut.com
- Helmestine, Anne Marie. Vahva hapon määritelmä ja esimerkki. Toipunut Ajatelukyvystä.com

