Hyposulfurinen happo
- 861
- 118
- Shawn Stanton II
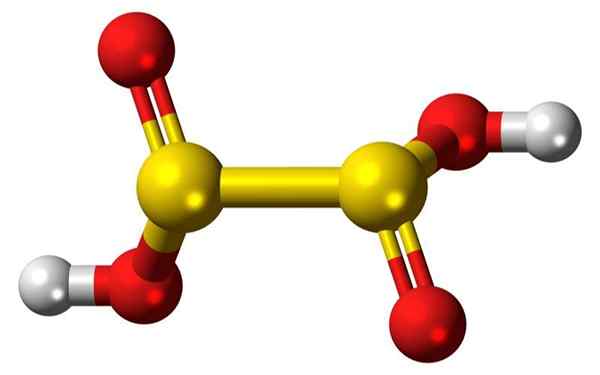
 3D -palkki ja hyposulfuroidun happomolekyylin ilmapallot. Lähde: Jynto
3D -palkki ja hyposulfuroidun happomolekyylin ilmapallot. Lähde: Jynto Mikä on hyposulfurinen happo?
Hän Hyposulfurinen happo, o dioniinihappo, se on tuntematon, epävakaa puhtaasti, sillä ei ole itsenäistä olemassaoloa eikä sitä ole havaittu vesiliuoksessa.
Teoreettisesti se olisi suhteellisen heikko happo, joka on verrattavissa rikkihappoon, H2SO3. Vain niiden suolat tunnetaan, dionitot, jotka ovat vakaita ja ovat voimakkaita pelkistäviä aineita. Natriumdionihapon suola on natrium dionito.
Kaavat
Hyposulfuroidut happokaavat ovat seuraavat:
Dioniinihappo: H2S2JOMPIKUMPI4
Dionito Anion: S2O42−
Natrium dionito: na2S2JOMPIKUMPI4
CAS -numero: 20196-46-7 Hyposulfurousihappo (tai dital)
CAS -numero: 14844-07-6 Hyposulfuroiva happo (tai ditio, ioni)
CAS -numero: 7775-14-6 Natrium dionito (hapon natriumatrium)
Fysikaaliset ja kemialliset ominaisuudet
- Natrium dionitosuolassa sen ulkonäkö on kiteinen, valkoinen harmahtavaa pölyä, kevyen ja heikon rikin hiutaleilla.
- Ditaatiohapon molekyylipaino on 130.132 g/mol. Dionito -anion, 128.116 g/mol ja natrium dionito, 174.096 g/mol.
- Natrium dioniton kiehumispisteessä se hajoaa ja sen sulamispiste on 52 ° C.
- Natrium dioniton tiheys on 2.38 g/cm³ (vedetön) ja sen liukoisuus veteen on 18.2 g/100 ml (vedetön, 20 ° C).
- Hyposulfurousihappo on rikki oksoasidi, jolla on kemiallinen kaava H2S2JOMPIKUMPI4.
- Rikkioksoasidit ovat kemiallisia yhdisteitä, jotka sisältävät rikkiä, happea ja vetyä. Jotkut heistä tunnetaan kuitenkin vain suoloistaan (kuten hyposulfuriina, dioidihappoa, disulfidihappoa ja rikkihappoa).
Se voi palvella sinua: Pyridiini: rakenne, ominaisuudet, käytöt, toksisuus, synteesiOksoasidien rakenteellisista ominaisuuksista, joita meillä on:
- Tetrahedrinen rikki koordinoida hapen kanssa.
- Happiatomit sillassa ja terminaalissa.
- Jaksojoukot.
- S = S -päätteet.
- (-S-) n ketjut
Rikkihappo on tunnetuin rikkihuksicid.
- Dionito -anioni ([S2JOMPIKUMPI4] 2-) on oksoanioni (ioni, jolla on geneerinen kaava axoy z-), joka on muodollisesti johdettu diatiinihapposta.
- Dionito -ionilla on sekä happo- että alkalinen hydrolyysi tiosulfaatiksi ja bisulfiitiksi sekä sulfiitille ja sulfidille.
- Natriumdionihapon suola on natriumdioniitti (tunnetaan myös nimellä natriumhydrosulfiitti).
- Se voidaan saada natriumbisulfiitista seuraavan reaktion kautta:
2 NAHSO3 + Zn → NA2Sw4 + Zn (OH) ²
Sovellukset
Dioniitti-ionia käytetään usein yhdessä kompleksisen aineen (esimerkiksi sitruunahappo) kanssa rautaoksi-hydroksidin (III) vähentämiseksi liukoisissa rautayhdisteissä (II) ja eliminoimaan amorfiset mineraalifaasit, jotka sisältävät rautaa (III) maaperässä maaperässä Analyysi (selektiivinen uutto).
Dionito mahdollistaa raudan liukoisuuden lisäämisen. Ion Dioniton voimakkaan affiniteetin ansiosta kaksisuuntaisille ja kolmiulotteisille metallikationille, sitä käytetään kelatiivisena aineena.
Dioniton hajoaminen tuottaa vähentyneitä rikkilajeja, jotka voivat olla erittäin aggressiivisia teräksen ja ruostumattoman teräksen korroosiolle.
Natrium dioton sovellusten joukossa meillä on:
Teollisuudessa
- Tämä yhdiste on vesiliukoinen suola, ja sitä voidaan käyttää pelkistävänä aineena vesiliuoksissa.
- Sitä käytetään sellaisenaan joissakin teollisuusväriaineprosesseissa, pääasiassa sellaisissa.
Voi palvella sinua: hapot: ominaisuudet ja esimerkit- Natrium dioniton pelkistysominaisuudet eliminoivat myös ylimääräisen väriaineen, jäännösoksidin ja ei -toivotut pigmentit, mikä parantaa värin maailmanlaajuista laatua.
- Natrium dionitoa voidaan käyttää myös vedenkäsittelyyn, kaasunpuhdistukseen, puhdistukseen ja uuttoon. Sitä voidaan käyttää myös teollisuusprosesseissa, kuten sulfonanttiaine tai natriumlähde.
- Tekstiiliteollisuuden lisäksi tätä yhdistettä käytetään nahkaan liittyvässä teollisuudessa, elintarvikkeissa, polymeereissä, valokuvauksessa ja monissa muissa. Sitä käytetään myös orgaanisten reaktioiden purettavana aineena.
Biologisissa tieteissä
- Natrium dionitoa käytetään usein fysiologiakokeissa keinona vähentää liuosten redox -potentiaalia.
Geologisissa tieteissä
- Natrium dionitoa käytetään usein maaperän kemiakokeissa raudan määrän määrittämiseksi, jota ei sisällytetä primaarisiin silikaattimineraaleihin.
Turvallisuus ja riskit
Tämän elementin manipulointi on tehtävä äärimmäisissä hoito -olosuhteissa. Se on erittäin myrkyllinen ja voi reagoida vaarallisesti veden ja ilman kanssa.
Seuraavaksi korostamme joitain näkökohtia.
Ilma- ja vesireaktiot
- Natrium dionito on kiinteä polttoaine, joka hajoaa hitaasti, kun se on kosketuksessa veden tai vesihöyryn kanssa, muodostaen tiosulfaatit ja bisulfiitit.
- Tämä reaktio tuottaa lämpöä, joka voi edelleen nopeuttaa reaktiota tai aiheuttaa ympäröivien materiaalien palamisen. Jos seos rajoittuu, hajoamureaktio voi johtaa säiliön paineeseen, joka voidaan rikkoa voimakkaasti. Ilmaan pysyessä se hapettaa hitaasti, tuottaen myrkyllisiä rikkidioksidikaasuja.
Voi palvella sinua: Nitrofuraanit: ominaisuudet, toimintamekanismi ja luokitteluPalovaara
- Natrium dionito on syttyvä ja palava materiaali. Voidaan tulkita kosketuksessa märän ilman tai kosteuden kanssa. Voit polttaa nopeasti leimahdusvaikutuksella. Voi reagoida voimakkaasti tai räjähtävästi kosketuksessa veden kanssa.
- Voidaan hajottaa räjähtävästi lämmitettäessä tai on mukana tulessa. Voi käynnistää uudelleen, kun tulipalo on sammutettu. Valuva voi aiheuttaa palo- tai räjähdysvaaraa. Kontit voivat räjähtää lämmitettäessä.
Terveysvaara
- Saatuaan kosketukseen tulipalon kanssa, natrium dionito tuottaa ärsyttäviä, syövyttäviä ja/tai myrkyllisiä kaasuja. Hajoamistuotteiden hengittäminen voi aiheuttaa vakavia vammoja tai kuolemaa. Kosketus aineen kanssa voi aiheuttaa vakavia palovammoja iholla ja silmillä. Palontorjunta voi aiheuttaa saastumista.
Viitteet
- Benjah-BMM27 (2006). Ditioniitti-ionin pallo-ja tarttuma malli [kuva] palautettu.Wikipedia.org.
- Myllyt, b. (2009). Natrium-ditionite -xtal-1992-3d-pallot [kuva] palautettu: In.Wikipedia.org.

