Sulfhydridihappo (H2S) -rakenne, ominaisuudet, käytöt, merkitys
- 1194
- 345
- Sheldon Kuhn
Hän sulfhydrinen happo o rikkivety on kaasu, joka muodostuu rikkiatomin (S) ja kahden vetyatomien (H) liitoksella,. Sen kemiallinen kaava on H2S. Se tunnetaan myös nimellä sulfidikaasu. Se on väritön kaasu, jonka haju näkyy mätäissä munissa.
Se on läsnä tulivuorissa ja rikkipohjaisissa kuumissa lähteissä, maakaasu- ja raakaöljyssä. Se muodostuu myös kasvien ja eläinten orgaanisen aineen anaerobisen (ilman happea) hajoamisen aikana. Sitä esiintyy luonnollisesti nisäkkäiden rungossa, tiettyjen entsyymien vaikutuksella kysteiiniin, ei -välttämättömään aminohappeen.
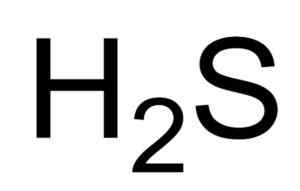
 Sulfhydric -hapon tai rikkivetyjen kemiallinen kaava. Saranphong Yimklan [julkinen alue]. Lähde: Wikimedia Commons.
Sulfhydric -hapon tai rikkivetyjen kemiallinen kaava. Saranphong Yimklan [julkinen alue]. Lähde: Wikimedia Commons. H: n vesiliuokset2S on syövyttävä metalleille, kuten teräkselle. H2S on pelkistävä yhdiste, joka reagoidessaan SO: n kanssa2 , Se hapettaa elementaalisen rikkiä samalla kun vähenee2 Myös rikki.
Huolimatta siitä, että se on erittäin myrkyllinen ja kohtalokas yhdiste ihmisille ja eläimille, sen merkitystä on tutkittu muutaman vuoden ajan tärkeiden prosessien sarjassa.
Säätelee sarjaa mekanismeja, jotka liittyvät uusien verisuonten muodostumiseen ja sydämen toimintaan.
Suojaa neuroneja ja ovat ajatelleet sen toimintaa sairauksien kaltaisia sairauksia vastaan.
Kemiallisen pelkistämisensä vuoksi voi taistella hapettavia lajeja, mikä vaikuttaa siten solujen ikääntymiseen. Näistä syistä tutkitaan mahdollisuutta tuottaa huumeita.
Tämän tarkoituksena on hoitaa patologioita, kuten iskemia, diabetes ja neurodegeneratiiviset sairaudet. Heidän toimintamekanismiaan ja turvallisuuttaan on kuitenkin edelleen tutkittava perusteellisesti.
[TOC]
Rakenne
H -molekyyli2S on analoginen veden kanssa, ts. Ne muistuttavat muotoa, koska hydrogenit sijaitsevat muodostaen kulman rikin kanssa.
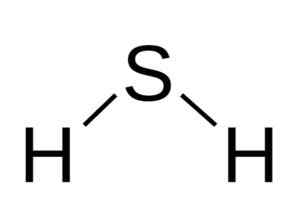 Sulfidihappomolekyylin kulmarakenne, H2S. Bangin [CC BY-SA 3.0 (http: // creativecommons.Org/lisenssit/by-SA/3.0/]]. Lähde: Wikimedia Commons.
Sulfidihappomolekyylin kulmarakenne, H2S. Bangin [CC BY-SA 3.0 (http: // creativecommons.Org/lisenssit/by-SA/3.0/]]. Lähde: Wikimedia Commons. Rikki h2S: llä on seuraava sähköinen kokoonpano:
1s2, 2s2 2 p6, 3s2 3P6,
Ota sitten kunkin vedyn elektroni sen valenssikerroksen täydentämiseksi.
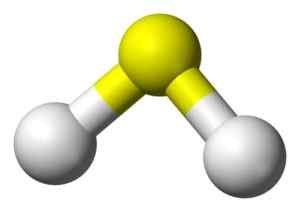 Sulfidihapon 3D -rakenne. Keltainen: Rikki. Valkoinen: vety. Benjah-BMM27 [julkinen alue]. Lähde: Wikimedia Commons.
Sulfidihapon 3D -rakenne. Keltainen: Rikki. Valkoinen: vety. Benjah-BMM27 [julkinen alue]. Lähde: Wikimedia Commons. Nimikkeistö
- Sulfhydrinen happo
- Rikkivety
- Rikin hydridi.
Fyysiset ominaisuudet
Fyysinen tila
Väritöntä kaasua, jolla on erittäin epämiellyttävä haju.
Molekyylipaino
34,08 g/mol.
Sulamispiste
-85,60 ºC.
Kiehumispiste
-60,75 ºC.
Tiheys
1 1906 g/l.
Liukoisuus
Kohtalaisen vesiliukoinen: 2,77 tilavuutta 1 vedessä 20 ºC: n nopeudella. Se voidaan häätää vesiliuoksesta kokonaan lähettämällä se kiehuvaksi.
Kemialliset ominaisuudet
Vesiliuoksessa
Kun rikkivety on vesipitoisessa liuoksessa, määritetään sulfhydric -hapon nimi. Se on heikko happo. Siinä on kaksi ionisoitavaa protonia:
H2S + h2Tai ⇔ h3JOMPIKUMPI+ + HS-, K -k -a1 = 8,9 x 10-8
HS- + H2Tai ⇔ h3JOMPIKUMPI+ + S2-, K -k -A2 ∼ 10-14
Ensimmäinen protoni on kevyesti ionisoitu, kuten voidaan päätellä sen ensimmäisestä ionisaatiovakiosta. Toinen protoni on hyvin vähän ionisoitu, mutta H: n ratkaisut2S sisältää jotain rikkianionista2-.
Jos H -liuos2S on altistunut ilmalle, O2 oksida sulfidianioniin ja rikki saostuu:
Voi palvella sinua: oksidit2 s2- + 4 h+ + JOMPIKUMPI2 → 2 h2O + 2 s0 -↓ (1)
Kloorin Cl: n läsnä ollessa2, Bromo br2 ja jodi i2 Vastaava vety ja rikki on muodostettu:
H2S + br2 → 2 HBR + S0 -↓ (2)
H: n vesiliuokset2S ovat syövyttäviä, tuottavat stressihalkausta sulfidin kanssa korkeissa kovissa teräksissä. Korroosiotuotteet ovat rautaa ja rikkivetyä.
Happireaktio
H2S reagoi ilman hapen kanssa ja seuraavat reaktiot voivat tapahtua:
2 h2S + 3 o2 → 2 h2O + 2 niin2 (3)
2 h2S + o2 → 2 h2O + 2 s0 -↓ (4)
Reaktio metallien kanssa
Se reagoi erilaisten metallien kanssa, jotka siirtyvät vetyyn ja muodostavat metallisulfidin:
H2S + PB → PBS + H2↑ (5)
Reaktio rikkidioksidin kanssa
Vulkaanisissa kaasuissa h on läsnä2S ja niin2, joka reagoi keskenään ja muodostuu kiinteää rikkiä:
H2S + niin2 → 2 h2O + 3 s0 -↓ (6)
Hajoaminen lämpötilan kanssa
Rikkivety ei ole kovin stabiili, se murtuu helposti kuumentamalla:
H2S → h2↑ + s0 -↓ (7)
Sijainti luonnossa
Tätä kaasua esiintyy luonnollisesti sulfidi- tai rikkipohjaisissa kuumissa jousissa, vulkaanisissa kaasuissa, raakaöljyssä ja maakaasussa.
 Rikkiveden miehen. Николай макимович [cc 3: lla.0 (https: // creativecommons.Org/lisenssit/by/3.0)]. Lähde: Wikimedia Commons.
Rikkiveden miehen. Николай макимович [cc 3: lla.0 (https: // creativecommons.Org/lisenssit/by/3.0)]. Lähde: Wikimedia Commons. Kun öljy (tai kaasu) sisältää merkittäviä H -jälkiä2S: n sanotaan olevan "hapan", toisin kuin "makea", jolloin se ei sisällä sitä.
Pienet määrät h2Öljyn tai kaasun S ovat taloudellisesti haitallisia, koska pesulaitos on asennettava sen poistamiseksi, sekä korroosion estämiseksi että jäännöskaasun turvaamiseksi kotimaan käyttöön polttoaineena.
Se tapahtuu aina, kun rikkiä sisältävä orgaaninen aine hajoaa anaerobisissa olosuhteissa (ilman puuttuminen), kuten ihminen, eläimet ja kasvijätteet.
 H -päästöt2S (sinertävä vihreä väri) NAMIBIA: n rannikolla, kuvannut NASA. Nämä päästöt tulevat orgaanisesta jätteestä. NASA: n maan observatorio [CC 2: lla.0 (https: // creativecommons.Org/lisenssit/by/2.0)]. Lähde: Wikimedia Commons.
H -päästöt2S (sinertävä vihreä väri) NAMIBIA: n rannikolla, kuvannut NASA. Nämä päästöt tulevat orgaanisesta jätteestä. NASA: n maan observatorio [CC 2: lla.0 (https: // creativecommons.Org/lisenssit/by/2.0)]. Lähde: Wikimedia Commons. Suussa ja maha -suolikanavassa olevat bakteerit tuottavat sen hajottavista materiaaleista, joita vihannekset tai eläinproteiinit sisältävät.
Sen tyypillinen haju aiheuttaa sen läsnäolon mätän munien varoittamista.
H2Sitä esiintyy myös tietyissä teollisissa toiminnoissa, kuten öljynjalostamoissa, koksin uuneissa, paperitehtaissa, sinulla olisi ja elintarvikkeiden jalostuksessa.
Synteesi nisäkkäiden rungossa
H2Endogeenistä voi esiintyä nisäkkäiden kudoksissa näiden ihmisen joukossa kahdella polulla, entsymaattisella ja ei -entsymaattisella tavalla.
Ei -entsymaattinen polku koostuu elementtien rikkien vähentämisestä0 - h: lle2S glukoosin hapettumisen kautta:
2 c6H12JOMPIKUMPI6 (glukoosi) + 6 s0 - (rikki) + 3 h2O → 3 c3H6JOMPIKUMPI3 + 6 h2S + 3 Co2 (8)
Voi palvella sinua: Kloori: Historia, ominaisuudet, rakenne, riskit, käyttötarkoituksetEntsymaattinen polku koostuu H H: stä2S L-kysteiinistä, joka on kehon syntetisoima aminohappo. Prosessin vakuutetaan useilla entsyymeillä, kuten kystatio.
 Lehmien aivoista on löydetty sulfhydric -happoa. Kirjoittaja: Arttower. Lähde: Pixabay.
Lehmien aivoista on löydetty sulfhydric -happoa. Kirjoittaja: Arttower. Lähde: Pixabay. Saadaan laboratoriossa tai teollisesti
Vetykaasu (H2) ja rikkielementti (t) ei reagoi normaaleihin ympäristölämpötiloihin, mutta näiden yläpuolella ne alkavat yhdistää, optimaalinen lämpötila on 310 ºC.
Prosessi on kuitenkin liian hidas, joten sen saamiseen käytetään muita menetelmiä, seuraavien joukossa.
Metallisulfidit (kuten rautasulfidi) reagoivat happojen (kuten hiiren) kanssa laimennetussa liuoksessa.
FES + 2 HCL → FECL2 + H2S ↑ (9)
Tällä tavalla kaasu saadaan2S, joka on sen myrkyllisyys, on kerättävä turvallisesti.
H: n teollisuuskäyttö2S rikin tuottamiseksi
Varastointi ja kuljetus suurina määrinä H2S, joka erottuu maakaasusta pesemällä amiinilla, on vaikeaa, joten Claus -prosessia käytetään sen muuttamiseen rikki.
 Öljynjalostamoissa H on erotettu2Maakaasua pesemällä amiinilla ja sitten tulee rikki. Kirjoittaja: Satyaprem. Lähde: Pixabay.
Öljynjalostamoissa H on erotettu2Maakaasua pesemällä amiinilla ja sitten tulee rikki. Kirjoittaja: Satyaprem. Lähde: Pixabay. Tässä prosessissa tapahtuu kaksi reaktiota. Ensimmäisessä h2S reagoi hapen kanssa antaakseen niin2, Kuten edellä mainittiin (katso reaktio 3).
Toinen on reaktio, jota katalysoi rautaoksidi, jossa SO2 on pelkistetty ja H2S hapettaa, ja nämä kaksi tuottavat rikkiä (katso reaktio 6).
Tällä tavoin saadaan rikkiä, joka voidaan helposti varastoida ja kuljettaa, samoin kuin jaettuna monikäyttöön.
H: n hyödyllisyys tai merkitys2S -endogeeninen organismissa
H2Endogeeni on se, joka esiintyy luonnollisesti organismissa osana ihmisen, nisäkkäiden ja muiden elävien olentojen normaalia aineenvaihduntaa.
Huolimatta pitkästä maineestaan olla myrkyllinen ja myrkyllinen kaasu, joka liittyy orgaanisen aineen hajoamiseen, useat äskettäiset tutkimukset 2000 -luvulta nykyiseen ovat todenneet, että H2S endogeeni on tärkeä säätelijä tietyille mekanismeille ja prosesseille elävässä olennossa.
H2S edustaa korkeaa lipofiilisyyttä tai affiniteettia rasvoihin, joten se ylittää solukalvot helposti, tunkeutuen kaikentyyppisiin soluihin.
Kardiovaskulaarinen järjestelmä
Nisäkkäissä sulfidihappo edistää tai säätelee sarjaa signaaleja, jotka säätelevät aineenvaihduntaa, sydämen toimintaa ja solujen eloonjäämistä.
Sillä on voimakas vaikutus sydämeen, verisuoniin ja veren kiertäviin elementteihin. Moduloi solujen aineenvaihduntaa ja mitokondriaalista toimintaa.
Puolustaa iskemian aiheuttamien vaurioiden munuaisia.
Maha -suolikanavajärjestelmä
On tärkeä rooli suojatekijänä mahalaukun limakalvojen vaurioista. Sen arvioidaan olevan tärkeä maha -suolikanavan liikkuvuuden välittäjä.
On todennäköistä, että se osallistuu insuliinin erityksen hallintaan.
Keskushermosto
Se toimii myös keskushermoston tärkeissä toiminnoissa ja suojaa oksidatiivisia stressi -neuroneja.
 Neuronit on suojattu h2Endogeeninen. Kirjoittaja: Gerd Altmann. Lähde: Pixabay.
Neuronit on suojattu h2Endogeeninen. Kirjoittaja: Gerd Altmann. Lähde: Pixabay. On arvioitu, että se voi suojautua neurodegeneratiivisilta sairailta, kuten Parkinsonin Parkinsonin, Alzheimerin ja Hungintonin taudilta.
Visio -urut
Suojaa valoreseptorisolut valon indusoimalta verkkokalvon degeneraatiolta.
Se voi palvella sinua: litiumkarbonaatti (LI2CO3): rakenne, ominaisuudet, käytötIkääntymistä vastaan
H2S: n pelkistävät lajit voidaan kuluttaa monilla kehossa kiertävillä hapettumisaineilla. Taistele hapettavia lajeja, kuten reaktiivisia happilajeja ja reaktiivisia typpilajeja kehossa.
Rajoita vapaiden radikaalien reaktioita aktivoitumalla antioksidanttientsyymejä, jotka suojaavat ikääntymisen vaikutuksilta.
H: n paranemispotentiaali2S toimitettu eksogeenisesti
H: n biologinen hyötyosuus2S endogeeninen riippuu tietyistä entsyymeistä, jotka osallistuvat kysteiinin biosynteesiin nisäkkäissä.
Jotkut tutkimukset viittaavat siihen, että lääkehoidon luovuttaja Don2S voi olla hyödyllinen tietyille patologioille.
Esimerkiksi, se voi olla hyödyllinen diabeetikoilla, koska on havaittu, että diabeetikoiden verisuonet paranevat lääkkeillä, jotka toimittavat H2S -eksogeeninen.
H2S tarjosi eksogeenisesti lisäämään angiogeneesiä tai verisuonten muodostumista, joten se voisi palvella kroonisten iskemiatautien hoitoon.
Suunnittelee huumeita, jotka voivat vapauttaa h2S hitaasti pystyä toimimaan hyödyllisesti eri sairauksien suhteen. Niiden toiminnan tehokkuus, turvallisuus ja mekanismit on kuitenkin edelleen tutkittava.
Riskejä
H2S on kohtalokas myrkky, jos se hengitetään puhdasta tai jopa laimennettuna 1 osa kaasua 200 osassa ilmaa. Linnut ovat erittäin herkkiä H: lle2S ja kuole jopa laimennettuna 1: stä 1500 ilmasta.
 Sulfidihappo tai rikkivety H2S on voimakas myrkky. Kirjailija: Openicons. Lähde: Pixabay.
Sulfidihappo tai rikkivety H2S on voimakas myrkky. Kirjailija: Openicons. Lähde: Pixabay. H2S on tiettyjen entsyymien ja oksidatiivisten fosforylaatioprosessien voimakas estäjä, mikä johtaa solujen tukehtumiseen. Suurin osa ihmisistä näkee sen olfitoriksi yli 5 ppb: n pitoisuuksissa (osa miljardia). 20-50 ppm: n pitoisuudet (osat miljoonaa) ovat ärsyttäviä silmille ja hengitysteille.
Hengitys 100-250 ppm muutaman minuutin ajan voi aiheuttaa koordinaation, muistin häiriöiden ja motoristen häiriöiden puutetta. Kun pitoisuus on noin 150-200 ppm2S. Jos 500 ppm: n pitoisuus hengitetään 30 minuutin ajan, keuhkoödeema ja keuhkokuume voidaan tuottaa.
Yli 600 ppm pitoisuudet voivat olla tappavia ensimmäisen 30 minuutin aikana, koska hengityselimet ovat halvaantuneet. Ja 800 ppm on pitoisuus, joka on heti tappava ihmiselle.
Siksi on vältettävä, että H -paeta2S laboratorioissa, paikallisessa tai missä tahansa tai tilanteessa.
On tärkeää varoittaa siitä, että monet kuolemat tapahtuvat, koska ihmiset tulevat pelastamaan työtovereita tai perheenjäseniä, jotka ovat romahtaneet H: n myrkytyksen takia2S, kuolee myös ne.
Se on syttyvä kaasu.
Viitteet
- Panthi, S. et al. (2016). Rikkivetyjen fysiologinen merkitys: nouseva POTNT -neuroprotektori ja neuromodulaattori. Oksidatiivinen lääketiede ja solun pitkäikäisyys. Volume 2016. Artikkelin tunnus 9049782. Hyndawi toipui.com.
- Shefa, u. et al. (2018). Rikkivetyen antioksidantti- ja solu-signalointitoiminnot keskushermostossa. Oksidatiivinen lääketiede ja solun pitkäikäisyys. Volume 2018. Artikkelin tunnus 1873962. Hyndawi toipui.com.
- Tabassum, r. et al. (2020). Rikkivetyjen terapeuttinen merkitys ikään liittyvissä neurodegeneratiivisissa sairauksissa. Neural Regen Res 2020; 15: 653-662. Nrronline palautettu.org.
- Martelli, a. et al. (2010). Rikkivety: Uusi mahdollisuus lääkkeiden löytämiseen. Lääketutkimuskatsaukset. Osa 32, numero 6. Haettu verkkokirjastosta.Viiva.com.
- Wang, M.-J -. et al. (2010). Angiogesin mekanismit: rikkivetyjen rooli. Kliininen ja kokeellinen farmakologia ja fysiologia (2010) 37, 764-771. Haettu verkkokirjastosta.Viiva.com.
- Dalefield, r. (2017). Savu ja muut hengitetyt toksikontit. Rikkivety. Eläinlääketieteellisessä toksikologiassa Australiassa ja Uudessa -Seelannissa. ScienEdirect.com.
- SELLEY, R.C. ja Sonnenberg, S.-Lla. (2015). Öljyn fysikaaliset ja kemialliset ominaisuudet. Rikkivety. Petroleum -geologian elementteissä (kolmas painos). ScienEdirect.com.
- Hocking, m.B -. (2005). Rikki- ja rikkihappo. Rikkivetyjen Claus -prosessin muuntaminen rikki. Kemiallisen tekniikan ja pilaantumisen hallinnan käsikirjassa (kolmas painos). ScienEdirect.com.
- Lefer, D.J -. (2008). Rikkivetyjen muutosten potentiaalinen merkitys (H2S) diabeteksen hyötyosuus. British Journal of Farmacology (2008) 155, 617-619. BPSPUBS: stä haettu.Verkkokirjasto.Viiva.com.
- TAI.S. Lääketieteen kansalliskirjasto. (2019). Rikkivety. Toipunut: Pubchem.NCBI.Nlm.NIH.Hallitus.
- Satama, j.-Lla. ja Ibarz, J. (1965). Moderni yleinen kemia. 7. painos. Marín -toimitus, S.-Lla.
- « Sosialistinen koulutus alkuperä, ominaispiirteet, periaatteet, esimerkit
- Uusklassinen teatterihistoria, ominaisuudet, edustajat, teokset »

