Rikkihappo
- 3798
- 983
- Gustavo Runte DVM
 Rikkihappo on mineraalihappo, joka tapahtuu, kun rikkidioksidi liukenee veteen
Rikkihappo on mineraalihappo, joka tapahtuu, kun rikkidioksidi liukenee veteen Mikä on rikkihappo?
Hän Rikkihappo Se on oksácido, joka muodostuu rikkidioksidin yhteydessä2, liukenee veteen. Se on heikko ja epävakaa epäorgaanihappo, jota ei voitu havaita liuoksessa, koska sen muodostumisen reaktio on palautuva ja happo hajoaa nopeasti sen tuottavissa reagensseissa (niin niin2 ja h₂o).
Se on väritön neste, jolla on voimakas rikin haju, epävakaa, ja sitä käytetään eri teollisuusalueilla, kuten kloorin värjättyjen materiaalien, lääketieteellisten ja kemiallisten tuotteiden synteesiä varten paperinvalmistukseen tai jalostusjohdannaisten puhdistamiseen öljyn johdannaisiin.
Rikkihappomolekyyli on tällä hetkellä havaittu vain kaasufaasissa. Tämän hapon konjugoidut emäkset ovat yleisiä anioneja sulfiittien ja bisulfiitin muodoissa.
Ramanin SO -ratkaisujen spektri2 Se näyttää vain SO -molekyylin aiheuttamat merkit2 ja bisulfiitti -ioni, HSO3-, yhdenmukainen seuraavan tasapainon kanssa:
Sw2 + H₂o HSO3- + H+
Tämä osoittaa, että Ramanin spektrillä se ei ole mahdollista.
Ilmakehän altistumisen jälkeen se muuttuu nopeasti rikkihapoksi. Rikkihappo pelkistetään rikkivetyksi, joka johtuu laimennetun rikkihapon ja sinkin vaikutuksesta.
Yritys keskittyä niin liuokseen2 Veden haihtumalla veden saamiseksi vapaa rikkihappo, se ei tuottanut tulosta, koska happo hajoaa nopeasti (investoimalla muodostumisreaktiota), joten happoa ei voida eristää.
Rakenne Rikkihappo
 Rikkihapon kemiallinen rakenne
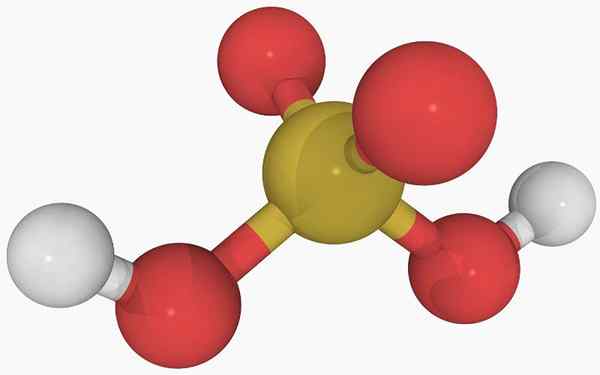
Rikkihapon kemiallinen rakenne Pääkuvassa voidaan nähdä rikkihappojen eristetyn molekyylin rakenne kaasumaisessa tilassa. Keskustassa oleva keltainen pallo vastaa rikkiatomia, punaisia happiatomeihin ja valkoisia hydrogeihin.
Voi palvella sinua: diastreeomeritSen molekyyligeometria S -atomin ympärillä on trigonaalista pyramidia, ja pohjan atomeja.
Sitten kaasumaisessa tilassa H -molekyylit2Sw3 Niitä voidaan pitää mikroskooppisena trigonaalisena pyramidina, jotka kelluvat ilmassa, olettaen, että ne ovat riittävän stabiileja kestämään jonkin aikaa reagoimatta.
Rakenne tekee selväksi, mistä kaksi happaa vety tulee: rikkiä kytkettyistä hydroksyyliryhmistä, Ho-OH-OH. Siksi tälle yhdisteelle ei ole oikein olettaa, että yksi happoprotoneista, H+, vapautuu rikkiatomista, H-niin2(VAI NIIN).
Kaksi OH -ryhmää sallivat rikkihappoa vuorovaikutuksessa vety silloilla, ja myös sidoksen happi s = o on vedyn hyväksyjä, joka tekee H2Sw3 sekä näiden siltojen hyvässä luovuttajassa että vastaanottajana.
Yllä olevan mukaan h2Sw3 Minun pitäisi pystyä tiivistämään nesteessä, kuten rikkihappo tekee, H2Sw4. Siitä huolimatta se ei tapahdu.
Fysikaaliset ja kemialliset ominaisuudet Rikkihappo
Molekyylikaava
H2Sw3
Molekyylipaino
82.073 g/mol.
Fyysinen ulkonäkö
Se on väritön neste, mausteisella rikkihajulla.
Tiheys
1.03 g/ml.
Höyrytiheys
2.3 (suhteessa 1)
Syövyttävyys
Se on syövyttävää metalleille ja kudoksille.
Vesiliukoisuus
Sekoittava.
Herkkyys
Se on ilmaherkkä.
Vakaus
Vakaa, mutta yhteensopimaton vahvojen emäksen kanssa.
Happamuusvakio (KA)
1.54 x 10-2
Pka
1.81
PHE
1.5 PH -asteikolla.
sytytyspiste
Ei syttyvä.
Hajoaminen
Kuumennettuna rikkihappoa voidaan hajottaa, mikä emoittuu rikkioksidin myrkyllisestä savusta.
Voi palvella sinua: Kromihydroksidi: rakenne, ominaisuudet, synteesi, käyttääNimikkeistö
Rikkillä on seuraavat valenssit: ± 2, +4 ja +6. Formulasta H2Sw3, Voidaan laskea, millä valenssi- tai hapettumisluvulla on rikki yhdisteessä. Tätä varten riittää ratkaista algebrallinen summa:
2 (+1) + 1 V + 3 (-2) = 0
Koska se on neutraali yhdiste, sen muodostavien atomien kuormien summa on 0. Selvä v edelliselle yhtälölle, sinulla on:
V = (6-2)/1
Siten V on yhtä suuri kuin +4. Toisin sanoen rikki osallistuu toisella Valencialla, ja perinteisen nimikkeistön mukaan jälkiliite on lisättävä nimeen -ooso. Tästä syystä h2Sw3 Se tunnetaan rikkihapponakarhu.
Toinen nopeampi tapa määrittää tämä Valencia, on verrata H2Sw3 H: n kanssa2Sw4.
H2Sw4 Rikkillä on Valencia +6, joten jos yksi tai Valencia laskee arvoon +4, ja jos toinen poistetaan, Valencia laskee arvoon +2 (mikä olisi happoa hikkaRikkikarhu, H2Sw2-A.
Vaikka vähemmän tunnettua, h2Sw3 Sitä voidaan kutsua myös trioksulfuriinihapoksi (IV), Stock -nimikkeistön mukaan.
Rikkihapon muodostuminen luonnossa
Rikkihappo muodostuu luonteeltaan rikkidioksidin yhdistelmästä, suurten tehtaiden aktiivisuuden tuotteesta, ilmakehän vedessä.
Tästä syystä sitä pidetään happojen sateen välituotena, joka aiheuttaa suuria vaurioita maataloudelle ja ympäristölle.
Synteesi
Teknisesti rikki muodostuu rikkidioksidin muodostamiseksi. Sitten se liukenee veteen rikkihapon muodostamiseksi. Reaktio on kuitenkin palautuvaa ja happo hajoaa nopeasti takaisin reagensseihin.
Tämä on selitys siitä, miksi rikkihappoa ei löydy vesiliuoksesta (kuten sen kemiallisen rakenteen osassa jo mainittiin).
Voi tarjoilla sinut: Beer-Lamben lakiSovellukset
Yleensä rikkihapon käyttöä ja sovelluksia, koska sen läsnäoloa ei voida havaita, viittaa rikkidioksidien käyttöön ja sovelluksiin sekä hapon perusteet ja suolat.
Puuhun
Sulfiittiprosessissa tapahtuu puinen massa melkein puhtaiden selluloosakuitujen muodossa. Ligniinin uuttamiseen puun sirpaleista käytetään useita rikkihapon suoloja käyttämällä korkeapaineisia astioita, joita kutsutaan keittimiksi.
Desinfiointiaine
Rikkihappoa käytetään desinfiointiaineena.
Valkaisu
Sitä käytetään myös pehmeänä valkaisuna, etenkin klooriherkoille materiaaleille. Lisäksi sitä käytetään hammasvalkaisuaineena ja elintarvikelisäaineena.
Kosmetiikka
Se on erilaisten kosmetiikan ainesosa ihonhoitoon, ja sitä käytettiin torjunta -aineelementtinä rottien eliminoinnissa. Eliminoi viinin tai hedelmien aiheuttamat tahrat eri kankaissa.
Antiseptinen
Se toimii antiseptisenä, joka on tehokas välttämään iho -infektioita. Joissain hetkinä sitä käytettiin fumigaatioissa alusten desinfiointiin, epidemioiden uhrien esineisiin jne.
Säilöntäaine
Rikkihappoa käytetään hedelmien ja vihannesten säilöntäaineena ja juomien, kuten viinin ja oluen käymisen, välttämiseksi, että se on antioksidantti, antibakteerinen ja siengisidinen elementti.
Kemialliset tuotteet
Rikkihappoa käytetään lääkkeiden ja kemikaalien synteesissä, viinin ja oluen kehittämisessä, öljystä johdettujen tuotteiden hienosäätöön ja analyyttisenä reagenssina.
Viitteet
- Happojen nimikkeistö. Toipunut 2: sta.Kemia.Gatech.Edu
- Calvo flores, f. G. Epäorgaaninen kemian formulaatio. UGR toipui.On

