Hapot ja emäkset erot, ominaisuudet, esimerkit
- 1642
- 293
- Mr. Clifford Kshlerin
Se hapot ja emäkset Ne ovat kemiallisia yhdisteitä, joissa ei ole yhtä määritelmää, vaan useita, jotka riippuvat otettujen ominaisuuksista tai ominaisuuksista. Yleisesti ottaen voidaan sanoa, että hapot ovat hapan aineita, kun taas emäkset ovat saponáceas tai saippuat.
Tärkeimmät määritelmät, kuten Brönsted-Lowry tai Arrhenius, keskittyvät enemmän H-ionien vapauttamiseen3JOMPIKUMPI+ (Hydronium) u oh-(hydroksyyli) näillä aineilla. Joko sen puhtaissa tai liuenneissa muodoissa vedessä.
Määritelmä, joka syntyy edellä mainitun seurauksena, on seuraava: Vesiin liukenevat hapot tuottavat liuoksia, joiden pH -arvot ovat pienempi kuin 7, kun taas liuenneen emäksen tuottavat liuokset, joiden pH -arvot ovat suurempia kuin 7. PH on tarkalleen tapa ilmaista, kuinka hapan tai emäksinen on neste ottaen huomioon H: n pitoisuus3JOMPIKUMPI+.
Siksi happamilla aineilla, kuten appelsiinimehulla, on alle 7 ja monissa H -ioneissa3JOMPIKUMPI+. Kun taas tukikohdilla, kuten Legía, on yli 7 ja monien OH -ionien pH-.
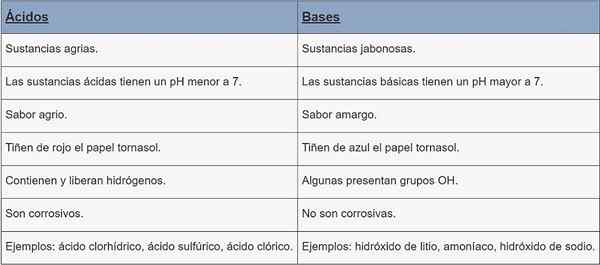
Hapot | Pohjat | |
Ainetyyppi | Maatalouden aineet. | Jabonesas -aineet. |
PHE | pH alle 7. | pH yli 7. |
Maku | Hapan. | Katkera. |
Värjäys | Punainen vesialue. | Cornstasol -paperiväri sininen. |
Ominaisuudet | Ne sisältävät ja vapauttavat vetyjä. | Jotkut läsnä OH -ryhmät. |
Korroosio | Ne ovat syövyttäviä. | Ne eivät ole syövyttäviä. |
Esimerkit | Suolahappo, rikkihappo, kloorihappo. | Litiumhydroksidi, ammoniakki, natriumhydroksidi. |
Hapot
 Appelsiinimehu on yksi päivittäisen elämämme tunnetuimmista happojen edustajista
Appelsiinimehu on yksi päivittäisen elämämme tunnetuimmista happojen edustajista Happoominaisuudet
Hapolla on tiettyjä ominaisuuksia:
Hapan maku
Hapoilla on hapan maku. Rutiininomaisesti maku on nimetty termillä 'happo'. Siten sanotaan, että sitruunamehu ja joidenkin ikenien neste ovat happoja, koska sen maut ovat hapan ja vahvat kitalaelle.
Punainen vesialue
Hapot ovat aineita, jotka kykenevät kääntämään sinisen ja punaisen suihkepaperin värin. Shortasol on osa aineita, jotka voivat muuttaa väriä riippuen sen ympäristön happamuuden asteesta tai emäksisyydestä. Näitä aineita kutsutaan pH -indikaattoreiksi.
Voi palvella sinua: ratkaisujen kolgatiiviset ominaisuudetNe sisältävät ja vapauttavat vetyjä
Hapot ovat kemiallisia yhdisteitä, joilla on vetykemiallinen elementti (H), mikä antaa sille happamuusominaisuuden.
Monet muut aineet sisältävät myös vetyä, mutta ne eivät voi vapauttaa sitä, kuten se tapahtuu happojen kanssa. Vapauttaessa vety on ionin tai kationin muodossa+. Nämä h+, Vesimolekyylejä täyttäessään ne lisätään näihin H -ionien muodostamiseksi3JOMPIKUMPI+.
He kuljettavat sähkövirtaa
H -atomien takia+ jotka vapautuvat, kun vedessä olevat hapot liuentaan, nämä kykenevät kuljettamaan sähköä paristojen tai paristojen avulla.
Ne ovat syövyttäviä
On vahvoja happoja, jotka ovat hyvin syövyttäviä. Siksi kosketusta heidän kanssaan on vältettävä, koska ne voivat aiheuttaa vakavia fyysisiä vaurioita. Jopa heikot hapot, erittäin korkeissa pitoisuuksissa, kuten etikka (etikka) voivat polttaa ihon ja nielun, jos niiden höyryt hengitetään.
Vahva ja heikko
Vahvat hapot tuottavat suuren pitoisuuden H -ioneja3JOMPIKUMPI+ Kun ne liukenevat veteen. Sanotaan. Sillä välin heikot hapot vapauttavat muutamia vetyatomeja ja tuottavat siksi pienemmän pitoisuuden H -ioneja3JOMPIKUMPI+.
Vahvoilla hapolla on erittäin matala pH, joka hapon pitoisuudesta ja voimasta riippuen se voi olla 1 tai vähemmän. Sen sijaan heikot hapot ovat korkeampi hapan pH, joka voi olla esimerkiksi 4 tai 5.
Vahvoilla hapolla on haju, joka tuottaa palavan sensaation. Sillä välin heikot hapot eivät ole tämän tyyppisiä hajuja, jopa joissain tapauksissa heillä on miellyttäviä hajuja. On kuitenkin monia poikkeuksia, joten niitä ei suositella haistamaan jopa heikkoja happoja.
Voi palvella sinua: rautaoksidi (III): rakenne, nimikkeistö, ominaisuudet, käyttötarkoituksetVahvat hapot ovat hyviä sähkön kuljettajia. Päinvastoin, heikot hapot ovat huonoja sähkön johtimia vapauttamalla muutama H -atomi+.
Vahvat hapot kykenevät hyökkäämään metalleja, kuten sinkkiä, muodostaen suuren määrän vetykuplia. Tätä reaktiota ei tuota heikot hapot.
Esimerkkejä hapoista
Vahvat hapot
-HCL: suolahappo
-H2Sw4: rikkihappo
-HBR: Bromhydric -happo
-Hei: Yodhydric -happo
-Hno3: typpihappo
-Hclo4: perkloorihappo
-Hclo3: Kloorihappo
Heikot hapot
-CH3COOH: etikkahappo
-Hno2: Typpihappo
-H2Yhteistyö3: Hiilihappo
-H3Poikki4: fosforihappo
-C3H5O (COOH): sitruunahappo
-HF: Fluorahappo
-H2Sw3: Rikkihappo
Pohjat
 Ammoniakki on perusaine
Ammoniakki on perusaine Perusominaisuudet
Perustat esittävät seuraavat ominaisuudet:
-Ne tuottavat sormet viskoosisen tai saippuan sensaation, aiheuttaen käten otetut esineet liukkaaksi.
-Heillä on katkera maku.
-Ne voivat reagoida happojen kanssa tuottaen suolaksi kutsuttujen yhdisteiden muodostumisen. Joissakin tapauksissa nämä voivat saostaa tai uppoaa veteen. Myös pohjan reaktiossa happoa, muodostuu vesi.
-Ne kääntävät sinisen itupaperin värin, mikä osoittaa, että liuoksen pH on suurempi kuin 7 tai emäksinen.
-Jotkut kemiallisissa kaava -ryhmissä olevat emäkset, joita kutsutaan hydroksillisiksi, jotka muodostuvat vetyatomilla ja happiatomilla.
Vahva ja heikko
Vahvat emäkset ovat kemiallisia yhdisteitä, jotka esittävät yhden tai useamman OH -ryhmän kemiallisessa rakenteessaan, mikä kun ne joutuvat kosketuksiin veden kanssa, saavat negatiivisen kuorman, OH-.
Sillä välin heikkoja emäksiä ei esiinny niiden kemiallisissa kaavahydroksiliryhmissä. Veden kanssa reagoidut heikot emäkset tuottavat kuitenkin myös ionit tai anionit OH-.
Vahvilla emäksillä, kuten natriumhydroksidilla, on erittäin korkeat pH -arvot, lähes 14. Samaan aikaan heikkojen emäksen pH: lla on alhaisempi pH, kuten ammoniakki, jonka pH on 11.
Voi palvella sinua: Keittäminen: Konsepti, tyypit ja esimerkitVahvoja emäksiä käytetään kodeissa viemärien paljastamiseksi. Näin on kaliumhydroksidi. Samaan aikaan puhdistustyössä käytetään heikkoja emäksiä, kuten monissa puhdistusaineissa.
Esimerkkejä tukikohdista
Vahvat tukikohdat
-Lioh: litiumhydroksidi
-NaOH: Natriumhydroksidi
-KOH: Kaliumhydroksidi
-RBOH: Rubidio -hydroksidi
-CSOH: Cesiumhydroksidi
-SR (OH)2: Strontiumhydroksidi
-Ba (OH)2: bariumhydroksidi
Heikot pohjat
-Nh3: Ammoniakki
-Nhet2: dietyyliamiini
-Nh2CH3: Metilamiini
-C5H5N: Pyridiini
Happojen ja emästen väliset erot
Ionit, jotka julkaisevat
Hapot vapauttavat H -atomeja+ tai h3JOMPIKUMPI+ Kun ne liukenevat veteen. Samaan aikaan tukikohdat vapautuvat tai tuottavat kosketuksessa vesi -ionien kanssa OH-.
PH -arvot
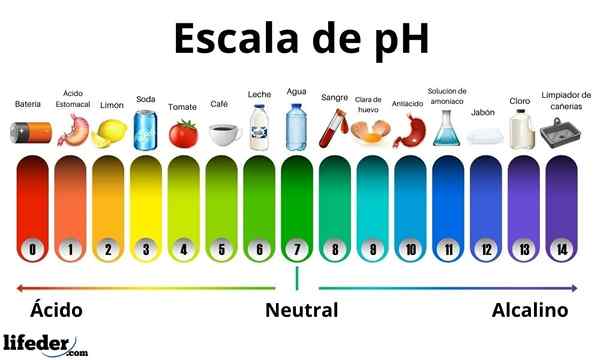
Hapoilla on pH -arvo välillä 0 - 7. Samaan aikaan emäksillä on pH -arvo välillä 7–14. Siksi hapot kääntävät itupaperin värin ja emäkset kääntävät sen sinisellä.
Koulutusreaktiot
Hapot ovat peräisin ei -metallisista elementtien oksidien, esimerkiksi kloorin, rikin jne. Reaktiosta., Vedellä tai ne muodostuvat myös, kun vety yhdistetään ei -metallisiin elementteihin ja sitten muodostettu yhdiste liukenee veteen (HF, HCL, HBR jne.-A.
Alustat tuotetaan metallin, esimerkiksi raudan, kuparin, magnesiumin jne. Oksidireaktiolla, jne., Vedellä. On muistettava, että oksidi on happiatomien yhdistelmä minkä tahansa muun kemiallisen elementin kanssa.
Viitteet
- Whitten, Davis, Peck & Stanley. (2008). Kemia. (8. ed.-A. Cengage -oppiminen.
- Helmestine, Anne Marie, PH.D -d. (11. helmikuuta 2020). Happamääritelmä ja esimerkki. Toipunut: Admingco.com
- Tiedetutkija. (31. heinäkuuta 2018). Lapsien opettaminen hapoista ja emäksistä. Toipunut: Science -Explorers.com
- Laatiminen. (2013). Happoominaisuudet. Palautettu: esimerkillinen.com
- Lumen-kemia ei-majoittajille. (S.F.-A. Happojen ja emästen ominaisuudet. Toipunut: kurssit.Lumenarning.com
- Clark Jim. (2013). Vahvat ja heikot perusteet. Talteenotettu: Chemguide.yhteistyö.Yhdistynyt kuningaskunta
- « Ecuadorian Sierran edustavien lajien kasvisto ja eläimistö
- Metodologinen kehys kuinka kirjoittaa, rakenne, esimerkkejä »

