Natriumkloriitti (NACLO2) rakenne, ominaisuudet, käytöt, riskit

- 4953
- 627
- Gustavo Runte DVM
Hän natriumkloriitti Se on epäorgaaninen kiinteä kiinteä aine, jonka on muodostettu ioni -natrium -na+ ja ionikloriitti2-. Sen kemiallinen kaava on Naclo2. Se on kiteinen valkoinen kiinteä aine, sen lisäksi, että se on vahva hapettava aine. Siksi sen on oltava erittäin varovainen.
Sen pääkäyttö on desinfiointiaineena monissa sovelluksissa. Se mahdollistaa mikrobien poistamisen pinnoilla, kuten lattiat, seinät ja laboratoriolaitteet sairaaloissa ja klinikoilla sekä niiden vesijärjestelmissä.
 Natriumkloriitti naclo2 kiinteä. Kirjailija: ChemicalIntest . Lähde: Wikimedia Commons.
Natriumkloriitti naclo2 kiinteä. Kirjailija: ChemicalIntest . Lähde: Wikimedia Commons. Myös maatalous- ja eläinlääketieteellisissä tiloissa, lintujen munanhautomoiden hygienisointiin, maitolehmien infektioiden hallitsemiseksi, eläinten vesijärjestelmien desinfioimiseksi jne.
Elintarviketeollisuudessa niiden happamat vesipitoiset liuokset palvelevat lihaa, kanoja, hedelmiä, vihanneksia sekä tällaisten tilojen laitteita.
Natriumkloriitin kanssa voidaan valmistaa klooridioksidi2 Käyttöpaikalla, jonka avulla voit eliminoida mikrobit, huonot hajut ja veden makuja niin, että se on miellyttävä ja voi juoda ilman ongelmia.
Se palvelee myös valkaisuaine -massaa, vihannestekstiilikuituja ja öljyjä muun muassa.
Naclo2 Kiinteä on käsiteltävä varoen, koska kosketuksessa tiettyjen materiaalien räjähdyksiä voi tapahtua. Niiden ratkaisuja on hiukan helpompi manipuloida, mutta ne ovat hyvin hapettuvia ja syövyttäviä.
[TOC]
Rakenne
Natriumkloriitti koostuu natriumkationista+ ja anionikloriittiklo2- Siksi ne yhdistyvät ioninen joukkovelkakirjalaina.
Kloriitti -anionissa on klooriatomi +3 -hapetustilassa ja kaksi happiatomia, joissa on Valencia -2. Tästä syystä kloriitti -anionilla on negatiivinen taakka.
Sillä on myös kulma -muotoinen rakenne.
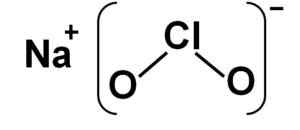 Naclo -natriumkloriittirakenne2. Kirjoittaja: Marilú Stea.
Naclo -natriumkloriittirakenne2. Kirjoittaja: Marilú Stea. Nimikkeistö
- Natriumkloriitti
- Natriumkloriitti
- Kloronatriumsuola
Ominaisuudet
Fyysinen tila
Kiteinen valkoinen kiinteä aine.
Molekyylipaino
90,44 g/mol.
Sulamispiste
Se hajoaa, kun se sulaa välillä 180 - 200 ºC.
Tiheys
2 468 g/cm3
Liukoisuus
Vesiliukoinen: 64 g/100 g vettä 17 ºC: n lämpötilassa. Liukenee hieman metanoliin.
Muut ominaisuudet
Se on hieman hygroskooppista.
Se on vahva hapettava aine. Reagoi väkivaltaisesti palavien materiaalien ja pelkistimien kanssa. Reagoi väkivaltaisesti happojen kanssa, tuottaen klooridioksidikloa2.
Voi palvella sinua: Hume-rothery -säännötSen emäksiset liuokset (se tarkoittaa esimerkiksi NaOH: n läsnä ollessa) ovat melko stabiileja, kun taas happamassa väliaineessa kloorihappo HCLO muodostuu2, joka hajoaa nopeasti:
4 HCLO2 → 2 CLO2↑ + Clo3- + Cl- + 2 h+ + H2JOMPIKUMPI
Riskejä
Molemmat naclo2 Kiinteät, koska heidän vesipitoiset liuokset ovat potentiaalisesti vaarallisia ja vaativat paljon varovaisuutta ja kokemusta manipuloinnin ja varastoinnin aikana.
Naclo2 Kiinteä voi räjähtää, kun joudutaan kosketuksiin orgaanisten aineiden kanssa, mukaan lukien käsineet ja vaatteet, vuodot -kontrollimateriaalit, kuten sahanpuru ja jäte puuvilla, sekä öljyt ja rasvat.
Kiinteä muotoa on siksi erittäin vaikea kuljettaa, ja se on suositeltavaa käyttää sitä vesipitoisten liuosten muodossa.
Nämä ratkaisut ovat erittäin syövyttäviä. Niiden tulisi mieluiten pitää pH: n yli 8, ts.
Naclo2 nopeuttaa yhdisteiden tai syttyvien materiaalien palamista siihen pisteeseen, että se voi muodostaa räjähtäviä seoksia näiden kanssa.
Jos lämmitetään, säteile HCl -suolahappoa ja natriumoksidia NA: n myrkyllisiä savuja2JOMPIKUMPI. Jos sitä jatketaan lämmön tai tuleen, se voi hyödyntää.
Saada
Se valmistetaan sodio naclon kemiallisella tai sähkökemiallisella pelkistyksellä3, HCL -suolahappon läsnä ollessa klooridioksidiklon tuottamiseksi2.
Jälkimmäinen reagoi vetyperoksidi H: n kanssa2JOMPIKUMPI2 NAOH -natriumhydroksidi -vesiliuosta ja natriumatriumkloriittiliuos saadaan2, joka haihtuu ja kiteyttää kiinteän.
Se voidaan saada myös ohittamalla klooridioksidikaasu2 NaOH -liuokseen.
2 CLO2 + 2 NaOH → Naclo2 + Naclo3 + H2JOMPIKUMPI
Sovellukset
Mikrobidi- ja desinfiointiaineena useissa sovelluksissa
Se on ainesosa lukuisista tuotteista, jotka hallitsevat bakteereja, sieniä ja lietteitä tai levää. Tätä tarkoitusta varten sisältäviä tuotteita käytetään maataloudessa, kaupassa, teollisuudessa ja asunnoissa tai koteissa.
Se toimii monen tyyppisten materiaalien ja pintojen desinfiointiaineeksi.
Maataloudessa siipikarja ja vastaavat teollisuudenalat ovat desinfioituja kovia pintoja, laitteita, lintujen munien inkubointia, sienten kasvihuoneita, kuten sieniä, sekä lintujen kynien jäähdytysvesi- ja vesivesijärjestelmiä.
Sillä on eläinlääketieteen käyttö paikallisena desinfiointiaineena lypsykarjan mastiitin hallinnassa eläimen nännien upottamiseksi. Mastiitti on lehmien tartunta.
Voi palvella sinua: Adiabaattinen prosessi: Tyypit, esimerkit, ratkaisut harjoitukset Joskus sinun on upotettava lehmiä natriumkloriittiliuoksiin niiden tartunnan välttämiseksi. Kirjoittaja: Hans Braxmeier. Lähde: Pixabay.
Joskus sinun on upotettava lehmiä natriumkloriittiliuoksiin niiden tartunnan välttämiseksi. Kirjoittaja: Hans Braxmeier. Lähde: Pixabay. Sitä käytetään myös luonnollisissa tutkimuslaitoksissa laboratorioiden puhdistamiseksi.
Kaupallisia, teollisia ja lääketieteellisiä käyttötarkoituksia ovat desinfiointi tuuletusjärjestelmät, kovat pinnat (kuten lattiat, seinät, laboratoriolaitteet) ja vesijärjestelmät.
Terveydenhuoltolaitoksissa, kuten klinikoilla ja sairaaloilla.
Se on hyödyllistä myös hygienisointiin laitoksissa, joissa ihmiset läpikäyvät vesi- tai kylpylän terveyshoitoja.
Elintarviketeollisuudessa sitä käytetään fumigantina ruoan säästämiseen.
Sitä käytetään happaman natriumkloriitin muodossa. Tätä tuotetaan lisäämällä elintarvikehappo (esimerkiksi sitruunahappo, fosforihappo, pyörähappo tai natriumhappo sulfaatti) natriumkloriitin vesiliuokseen.
Happamatriumikloriitilla on antimikrobisia ominaisuuksia, ja sitä käytetään kaste- tai kananpesuna tai liotusliuoksena, lihaa, vihanneksia, hedelmiä ja merituotteita. Myös vedessä kanan tai lintujen jäädyttämiseksi.
Kotitalouksissa se mahdollistaa kovien pintojen desinfioinnin, kuten lattiat ja kylpyhuoneet, lämmitys- tai ilmastointijärjestelmät ja uima -altaan vedenkiertojärjestelmät.
 Desinfiointiaaltojen desinfiointi voit käyttää natriumkloriitti naclo2. Kirjoittaja: Age Global Group. Lähde: Pixabay.
Desinfiointiaaltojen desinfiointi voit käyttää natriumkloriitti naclo2. Kirjoittaja: Age Global Group. Lähde: Pixabay.  Natriumkloriittien sisältävät tuotteet sallivat wc -kylpyhuoneet. Kirjoittaja: Michal Jarmoluk. Lähde: Pixabay.
Natriumkloriittien sisältävät tuotteet sallivat wc -kylpyhuoneet. Kirjoittaja: Michal Jarmoluk. Lähde: Pixabay. Sitä myydään myös pieninä pussissa yhdessä muiden yhdisteiden kanssa kaasun vapauttamiseksi ja hajujen hallitsemiseksi kodeissa.
Desinfioida juomavettä
Sitä käytetään juoman veden puhdistamisessa, toimii hapettimena, parantamalla juomaveden makua ja tuoksua.
Natriumkloriittiä käytetään laajalti edeltäjänä klooridioksidin muodostumiselle2 joka palvelee juomavettä ihmisravinnoksi, ts. Mikro -organismien, hajujen ja epämiellyttävien makujen poistamiseksi ja voi juoda.
Cloin luominen2 HCL: tä voidaan käyttää:
5 naclo2 + 4 HCL → 4 CLO2↑ + 5 NaCl + 2 H2JOMPIKUMPI
Clo2 Se on antimikrobinen aine korkean vaikutuksen hapettimesta ja laajasta spektristä. Toisin sanoen, toimii suurta määrää mikro -organismeja.
Se voi palvella sinua: kaliumnitriitti (kno2): rakenne, ominaisuudet ja käytötMikro -organismit deaktivoidaan, koska CLO2 häiritsee näiden tärkeitä entsyymejä ja solukalvojen proteiineja. Sillä on myös se etu, että se ei tuota myrkyllisiä organoklooriyhdisteitä.
Myytävänä natriumkloriittitabletit sekoitetaan muihin yhdisteisiin, jotka on liuennut veteen ja tuottavat heti CLO: n2 hallitulla tavalla, siten veden desinfiointi.
 Natriumkloriittia käytetään muiden yhdisteiden kanssa juomaveden saamiseksi valmis juomaan. Kirjoittaja: Ulrike Leone. Lähde: Pixabay.
Natriumkloriittia käytetään muiden yhdisteiden kanssa juomaveden saamiseksi valmis juomaan. Kirjoittaja: Ulrike Leone. Lähde: Pixabay. Tärkein ongelma veden hoidossa makujen poistamiseksi ja haisee CLO: n läpi2 Se koostuu siitä, että myrkyllinen kloriitti- ja kloorisuolat voidaan muodostaa hoidon aikana.
Kosketuslinssinhoito
Naclo2 Se on osa liuoksia, joita käytetään piilolinssien desinfiointiin.
Käytetään naclo -yhdistelmää2 ja vetyperoksidi H: n jäljet (hyvin pienet määrät)2JOMPIKUMPI2.
H2JOMPIKUMPI2 Vakauttaa CLO2 Se on muodostettu ja molempien yhdistelmä on erittäin tehokas bakteereja, sieniä ja hiivoja vastaan. Tuolloin ovat natriumkloridia, vettä ja happea, jotka ovat vaarattomia, mikä tarkoittaa, että ne eivät ole haitallisia silmille.
Kun linssit poistetaan liuoksesta, Naclo2 Jäännös hajoaa nopeasti Nallissa ja O2. Jäännösperoksidi ei ärsytä silmää. Siksi nämä ratkaisut ovat erittäin turvallisia.
 Kosketuslinssien desinfiointiin liittyvät liuokset ovat natriumkloriittia niiden ainesosien joukossa. Kirjoittaja: Nieuw ~ commonswiki. Lähde: Wikimedia Commons.
Kosketuslinssien desinfiointiin liittyvät liuokset ovat natriumkloriittia niiden ainesosien joukossa. Kirjoittaja: Nieuw ~ commonswiki. Lähde: Wikimedia Commons. Erilaisissa sovelluksissa
Klooridioksidin valmistukseen käytetään natriumkloriittiä2 Välitöntä käyttöä monissa sovelluksissa, joista jotkut käsiteltiin aiemmissa kappaleissa.
Se palvelee valkaisuainetta, tekstiilejä, kuten puuvillaa, kasvikuituja, syötäviä ja ei -kumottavia öljyjä, rasvoja, lakkaa, lakkaa ja vahoja.
Se on osa silmätippoja ja joitain ratkaisuja suun pesuun.
Sitä käytetään nahkapyyntöteollisuudessa ja metallielektrodin aineissa (metallipinnoite).
Viitteet
- Williams, L. et al. (2019). Mikrobiologia, linssinhoito ja ylläpito. Kosketuslinsseissä (kuudes painos). ScienEdirect.com.
- TAI.S. Lääketieteen kansalliskirjasto. (2019). Natriumkloriitti. PubChemistä toipunut.NCBI.Nlm.NIH.Hallitus.
- Harmaa, n.F. (2014). Klooridioksidi. Prosessitekniikka. Vesien sairauksien mikrobiologiassa (toinen painos). ScienEdirect.com.
- McKen, L. (2012). Johdatus ruoka- ja lääketieteelliseen sterilointiin. Klooridioksidi. Steriloinnin vaikutuksesta muoviin ja elastomeereihin (kolmas painos). ScienEdirect.com.
- Ortenberg, E. ja Telsch, b. (2003). Maku- ja hajuongelmat juomavedessä. Vesi- ja jäteveden mikrobiologiassa. ScienEdirect.com.
- Karsa, D.R -. (2007). Biosidit. Klooridioksidi. Käsikirjassa pintojen puhdistamiseen/puhdistamiseen. ScienEdirect.com.
- Puuvilla, f. Albert ja Wilkinson, Geoffrey. (1980). Edistynyt epäorgaaninen kemia. Neljäs painos. John Wiley & Sons.
- Ullmannin teollisuuskemian tietosanakirja. (1990). Viides painos. Vch verlagsgellschaft mbh.

