Kalsiumkloridi (CACL2)
- 1033
- 20
- Edgar VonRueden
Selitämme, mitä kalsiumkloridia, sen rakennetta, fysikaalisia ja kemiallisia ominaisuuksia, miten se syntetisoidaan ja sen sovellukset ovat
Mikä on kalsiumkloridi?
Hän kalsiumkloridi (CACl2) Se on epäorgaaninen suola, joka koostuu kalsiumista, alkalista metallista ja halogeenikloorista. Tässä yhdisteessä on useita sähköstaattisia vuorovaikutuksia, jotka määrittelevät kiteidensä ulkoisen ulkonäön ja loput sen fysikaaliset ominaisuudet.
Siihen liittyy myös vesimolekyylit, muodostaen CoCL: n yleiset kaava hydraatit2· XH2Tai, x = 0, 1, 2, 4 ja 6. Kun x = 0, suolasta puuttuu vettä ja se on anhydridi, kuten sen edellä mainitulla kemiallisella kaavalla osoittaa.
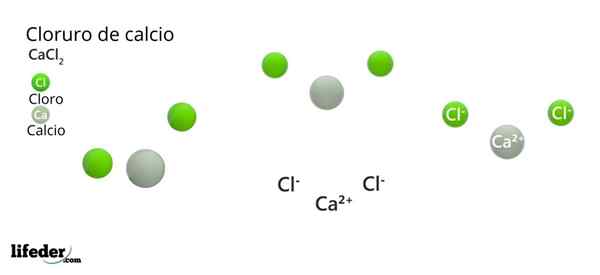
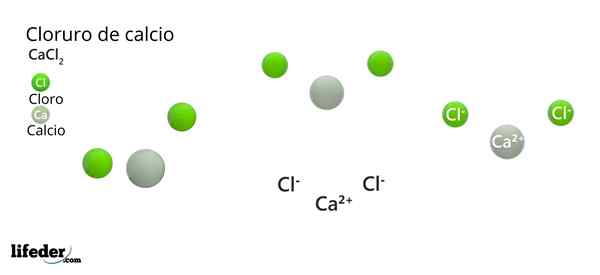
Ylemmässä kuvassa on havainnollistettu joitain kiinteitä CACL -osia2. Pienen kosteuden olosuhteissa se on mahdollista.
Kaava
Sen kemiallinen kaava on CACL2: Ilmaisee sen jokaiselle Ca -ionille2+ On kaksi Cl -ionia- jotka neutraloivat positiivisen kuorman. Jaksollisen taulukon ryhmän 2 kalsiummetalli -ryhmä 2 (SR. Scholambara)- tuottaa kaksi elektroniaan jokaiselle klooriatomille, ryhmäelementti 17.
Kalsiumkloridirakenne
Ylemmässä kuvassa CACL -rakenne on havainnollistettu2 anhydridi. Vihreät pallot vastaavat Cl -ioneja-, kun taas valkoinen ioneille CA2+. Nämä pallot on kiinnitetty rinnakkaiskipiin, mikä ei ole muuta kuin kiteiden yhtenäinen ortorrominen solu.
Rakenne voi antaa väärän kuvan siitä, että kalsium hallitsee; Kuitenkin, jos yksikkösolun toistoja toistetaan, vihreiden pallojen suurin runsaus olisi selvä: Cl -ionit-.
Toisaalta Ca -ionit2+ Niillä on pienempi ioniradio kuin Cl -ionilla-. Tämä johtuu siitä, että kun he menettävät elektroneja, atomien ytimet aiheuttavat suurempaa houkuttelevaa voimaa ulkoisiin elektronisiin kerroksiin, mikä vähentää ionista sädettä.
CL: n tapauksessa-, Tällä on ylimääräinen elektroni, jota ei voida houkutella samaan voimalle, mikä lisää sen ionista sädettä.
Voi palvella sinua: vesipitoiset ratkaisutMolekyyligeometria ja vesipitoiset kalsiumkompleksit
Rinnakkaiskipien keskellä CA2+ Sitä ympäröi kuusi Cl-. Näistä neljä on neliötasossa ja kaksi muuta sijaitsee kohtisuorassa (valkoisen pallon syrjäisimmät vihreät pallot).
Näiden ionien järjestelyn seurauksena CA: n ympärillä2+ Octaedro on "ase", mikä osoittaa oktaedrisen molekyyligeometrian.
Kun otetaan huomioon, kuinka vihreät pallot on järjestetty, vesimolekyyli voi korvata yhden näistä, joka tapahtuu aivohalvauksella2· H2Tai mahdollisesti neliötasossa. Tämä tosiasia muuttaa kiteistä rakennetta ja kun vesi korvaa vihreät pallot, ionijärjestely muuttaa enemmän.
Kun kaikki Cl -ionit- Ne korvataan vesimolekyyleillä, CACL -hydraatti muodostuu2· 6H2JOMPIKUMPI. Tässä vaiheessa oktaedri on "vesipitoinen" ja molekyylit kykenevät nyt vuorovaikutukseen niiden välillä vety silloilla (CA2+ Oh-h-Oh2-A.
Peräkkäin kalsium voi hyväksyä vielä enemmän vesimolekyylejä muuttamatta vakiintunutta osuutta. Tämä tarkoittaa, että CACL2· 6H2Tai voi ottaa käyttöön muita kompleksirakenteita siihen pisteeseen, että kalsiumin ja veden kiteisiä polymeerejä harkitaan.
Nämä rakenteet ovat kuitenkin vähemmän stabiileja kuin sähköstaattiset vuorovaikutukset (CA2+ ja cl-) anhydridisuolasta.
Kalsiumkloridin käyttö/sovellukset
Kalsiumkloridin tärkeimmät sovellukset ovat:
- Vältä veden jäätymistä talvella. Kalsiumklorid. Tästä syystä sitä käytetään vähentämään ihmisten ja ajoneuvojen verenkierron riskiä kylmän aseman aikana.
- Auta hallitsemaan pölyä päällystämättömillä teillä.
- Nopeuttaa betonin kuivausnopeutta kaadettuna.
- Cachl -nesteet2 Kaasun louhinnan porauksen tehokkuus niiden maanalaisista kerrostumista kasvaa, samoin kuin öljy.
- Altaat lisätään seinien betonin kärsimän eroosion vähentämiseksi. Sedimmentoitu kalsium täyttää tämän toiminnon.
- Koska se on hygroskooppinen suola, kalsiumkloridia voidaan käyttää liukenevana, kykenevää vähentämään ympäröivän ilman kosteutta ja siksi kyseisen ilman kanssa kosketuksissa olevista aineista.
- Sitä käytetään säilöntäaineena joissakin ruokia, samoin kuin additiivia useissa, kuten urheilijoiden, juustojen, oluiden jne. Käyttämät energiajuomat, jne.
- Lääketieteellisessä käytännössä sillä on myös hyötyä magnesiumsulfaatin yliannostuksen aiheuttaman masennuksen hoidossa sekä lyijymyrkytyksissä.
Kalsiumkloridin synteesi
Tämän yhdisteen luonnolliset lähteet ovat Salmueras, joka on uutettu merestä tai järvistä.
Sen tärkein lähde tulee kuitenkin Solvay -prosessista, jossa kalkkikivi (Caco3) kärsivät sarjan muunnosmuotoja, kunnes ne on johdettu by -tuotteen kalsiumkloridiin:
2nacl (aq) + caco3(s) na2Yhteistyö3(s) + cacl2(AC)
Tämän prosessin kiinnostava tuote on oikeastaan natriumkarbonaatti, na2Yhteistyö3.
Kalsiumkloridin ominaisuudet
Fyysiset ominaisuudet ja herkut
Se on valkoinen, wc ja hygroskooppinen kiinteä aine. Tämä taipumus imeä ympäristön kosteutta johtuu Ca -ionien emäksestä2+.
Millainen perusteetti: Lewis tai Bronsted? Lewis, koska positiiviset lajit kykenevät hyväksymään elektroneja. Nämä elektronit lahjoitetaan esimerkiksi vesimolekyylien happiatomilla.
Kiinteä aine imee kosteuden liukenemiseen samaan veteen, joka kostaa sen kiteitä. Tämä ominaisuus tunnetaan nimellä Delicuescencia.
Sen tiheys on 2,15 g/ml. Koska se sisällyttää vettä rakenteeseensa, kide on ”laajentunut”, lisäämällä sen tilavuutta ja siten vähentämällä tiheyttä. Vain cacl2· H2O Katkaise tämän suuntauksen kanssa, mikä osoittaa suuremman tiheyden (2,24 g/ml).
Anhydridisuolan molekyylipaino on noin 111 g/mol ja jokaiselle sen rakenteen vesimolekyylille tämä paino lisää 18 yksikköä.
Liukoisuus
CACL2 Se on hyvin liukoinen veteen ja joissakin polaarisissa liuottimissa, kuten etanoli, etikkahappo, metanoli ja muut alkoholit.
Lämmönlämpö
Kun prosessi on liuennut veteen, se on eksoterminen ja lämmittää siten liuosta ja sen ympäristöä.
Voi palvella sinua: mistä muovi tulee? Historia ja tyypitTämä johtuu siitä, että vesikompleksi stabiloi paremmin Ca -ionit2+ liuoksessa, että sähköstaattiset vuorovaikutukset Cl -ionien kanssa-. Koska tuote on vakaampi, kiinteä kiinteä vapauttaa energiaa lämmön muodossa.
Elektrolyyttinen hajoaminen
CACL2 Sula voidaan altistua elektrolyysille, fysikaalinen prosessi, joka koostuu yhdisteen erottamisesta sen elementteihin sähkövirran vaikutuksesta. Tämän suolan tapauksessa tuotteet ovat metallisia kalsiumia ja kaasumaista klooria:
Kacl2(l) → Ca (s) + Cl2(g)
Ionit ca2+ Ne vähenevät katodissa, kun taas Cl -ionit- Ne hapetetaan anodissa.
Viitteet
- Wikipedia. (2018). Kalsiumkloridi. Haettu jstk.Wikipedia.org
- Shiver & Atkins. (2008). Epäorgaaninen kemia. Ryhmässä 2. (Neljäs painos., p. 278). MC Graw Hill.
- Pubchem. (2018). Kalsiumkloridi. PubChemistä toipunut.NCBI.Nlm.NIH.Hallitus.
- Oksikemi. Kalsiumkloridi: Opas fysikaalisiin ominaisuuksiin. Oksi talteenotettu.com
- Carole Ann. Kalsiumkloridin yleinen käyttö. Hunker toipunut.com