Kromikloridi (CRCL3) rakenne, ominaisuudet, käytöt

- 894
- 202
- Mr. Clifford Kshlerin
Hän Kromikloridi (CRCL3-A Se on epäorgaaninen suola, joka koostuu CR -kationeista3+ ja cl -anionit- 1: 3 -suhteessa; eli jokaiselle CR: lle3+ CL on kolme-. Kuten myöhemmin nähdään, niiden vuorovaikutukset eivät ole ionisia. Tätä suolaa voi esiintyä kahdessa muodossa: anhydra ja heksahydraatti.
Vedolliselle muotolle on ominaista violetti-punainen väri; Hexahydraattia, crcl3.6H2Tai se on tummanvihreä. Vesimolekyylien sisällyttäminen muuttaa näiden kiteiden fysikaalisia ominaisuuksia; sen kiehumis- ja fuusiopisteinä, tiheyksillä jne.
 Kromikloridin (III) violetti-joen kiteet vedettömät. Lähde: Ben Mills [julkinen alue]
Kromikloridin (III) violetti-joen kiteet vedettömät. Lähde: Ben Mills [julkinen alue] Kromikloridi (III) (varastossa olevan nimikkeistön mukaan) hajoaa korkeissa lämpötiloissa, ja siitä tulee kromikloridi (II), CRCL2. Se on syövyttävää metalleille, vaikka sitä käytetään kromissa: menettelytapa, jossa metallit peitetään ohuella kromikerroksella.
Cr3+, Kloridistaan tulee sitä, sitä on käytetty diabeteksen hoidossa, etenkin potilailla, joilla on kokonainen parenteraalinen ravitsemus (TPN), jotka eivät nieltä vaaditun kromin määrää. Tulokset ovat kuitenkin paljon parempia (ja luotettavampia), jos se toimitetaan pikolinatona.
[TOC]
Kromikloridirakenne
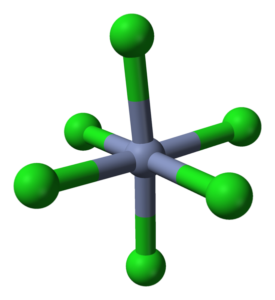 Octaedro -koordinointi CRCL3: lle sen kiteissä. Lähde: Ben Mills [julkinen alue]
Octaedro -koordinointi CRCL3: lle sen kiteissä. Lähde: Ben Mills [julkinen alue] CRCL3 Huolimatta suolasta, niiden vuorovaikutuksen luonne ei ole puhtaasti ioninen; Heillä on tietty kovalenttinen luonne, CR: n välisen koordinaation tuote3+ ja cl-, jotka aiheuttavat epämuodostuneen oktaedron (ylivoimainen kuva). Kromi sijaitsee Octaedron keskellä ja klorot sen kärjessä.
Oktaedron crcl6 Voit ensi silmäyksellä olla ristiriidassa CRCL -kaavan kanssa3; Tämä täydellinen oktaedroni ei kuitenkaan määrittele lasin yksikkösolua, vaan kuutio (myös muodonmuutos), joka leikkaa vihreät pallot tai kloorianionit puoliksi.
Voi palvella sinua: 20 esimerkkiä kemiallisesta sublimaatiosta ja ominaisuuksistaVedettömät kiteiset kerrokset
Siten tämän Octaedron yhtenäinen solu ylläpitää edelleen osuutta 1: 3. CRCL -kide saadaan nämä muodonmuutoskuutiot avaruudessa3, joka on edustettuna ylemmässä kuvassa kolmen dimensioisen täyttömallin ja mallin palloista ja palkista.
 CRCL3 -kiderakenteen kerros, jota edustaa kolmiulotteisilla palloilla ja baarimallilla. Lähde: Ben Mills [julkinen alue]
CRCL3 -kiderakenteen kerros, jota edustaa kolmiulotteisilla palloilla ja baarimallilla. Lähde: Ben Mills [julkinen alue] Tämä kiteinen kerros on yksi monista, jotka tekevät3 (Älä sekoita lasin väriä, totta, vihreiden pallojen väriä).
Kuten voidaan nähdä, Cl -anionit- He miehittävät pinnan, joten niiden negatiiviset kuormat torjuvat muut kiteiset kerrokset. Tämän seurauksena kiteistä tulee huijauksia ja hauraita; Mutta loistava, kromin takia.
Jos nämä samat kerrokset visualisoidaan sivuttaisnäkymästä, sitä havaitaan oktaedran sijasta, vääristyneitä tetraedereitä:
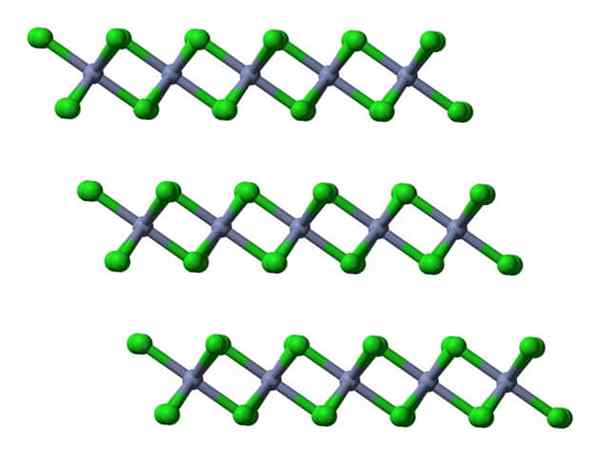 Crcl3 kiteiset kerrokset näkymät sivusuunnassa. Lähde: Ben Mills.
Crcl3 kiteiset kerrokset näkymät sivusuunnassa. Lähde: Ben Mills. Tässä ymmärrys siitä, miksi kerrokset hylätään toistensa kanssa, helpotetaan, kun CL- sen pintojensa.
Ominaisuudet
Nimeä
-Kromikloridi (III)
-Kromitrikloridi (III)
-Kromikloridi (III) vedetön.
Kemiallinen kaava
-CRCL3 (vedetön).
-CRCL3.6H2O (heksa).
Molekyylipaino
-158,36 g/mol (vedetön).
-266,43 g/mol (heksahydraatti).
Fyysinen kuvaus
-Kiinteät ja violetti-redistiset kiteet (vedettömät).
-Tummanvihreä kiteinen pöly (heksahydraatti, alempi kuva). Tässä hydraatissa se voidaan nähdä, koska vesi estää kirkkautta, metallikrome -ominaisuutta.
 Heksahydraatti kromikromi. Lähde: Käyttäjä: Walkerma [julkinen verkkotunnus]
Heksahydraatti kromikromi. Lähde: Käyttäjä: Walkerma [julkinen verkkotunnus] Sulamispiste
-1.152 ºC (2.106 ºF, 1.425 K) (Anhydrum)
-83 ºC (heksahydraatti).
Kiehumispiste
1300 ºC (2.370 ºF, 1.570) (Anhydrum).
Vesiliukoisuus
 Kromikloridin (III) vesiliuokset (III). Lähde: Leiem [CC BY-SA 4.0 (https: // creativecommons.Org/lisenssit/by-SA/4.0)]
Kromikloridin (III) vesiliuokset (III). Lähde: Leiem [CC BY-SA 4.0 (https: // creativecommons.Org/lisenssit/by-SA/4.0)] -Lievä liukoinen (anhydro).
-585 g/l (heksahydraatti).
Yläkuvassa esitetään sarja testiputkia, jotka on täytetty vesiliuoksella CRCL3. Huomaa, että mitä keskittyneempi, sitä voimakkaampi kompleksin väri [CR (OH2-A6-3+, Vihreä väri vastuullinen.
Voi palvella sinua: putrescina: rakenne, ominaisuudet, synteesi, käyttöLiukoisuus orgaanisiin liuottimiin
Liukoinen etanoliin, mutta liukenematon eetteriin (vedetön).
Tiheys
-2,87 gr/cm3 (vedetön).
-2,76 g/cm3 (Heksahydraatti).
Säilytyslämpötila
Hajoaminen
Kromikloridi (III) kuumennettuna hajoamiseen säteilee klooria sisältävien yhdisteiden myrkyllisiä höyryjä. Nämä yhdisteet vapautuvat myös, kun kromikloridi (III) joutuu kosketukseen vahvojen happojen kanssa.
Korroosio
Se on erittäin syövyttävä ja voi hyökätä tiettyihin teräksiin.
Reaktiot
Se on yhteensopimaton vahvojen hapettimien kanssa. Se reagoi myös voimakkaasti litiumin ja typen kanssa.
Kun sitä lämmitetään vedyn läsnä ollessa, se pelkistetään kromikloridiksi (II) vetykloridin muodostuessa.
2 CRCL3 + H2 => 2 CRCL2 + 2 HCL
PHE
Vesiliuoksessa ja pitoisuudella 0,2 M: 2,4.
Synteesi
Kromikloridi (III) -heksahydraattia tuotetaan, mikä reagoi kromihydroksidiin suolahapon ja veden kanssa.
Cr (OH)3 + 3 hCl +3 h2O => crcl3.6H2JOMPIKUMPI
Sitten anhydahuolan saamiseksi CRCL kuumennetaan3.6H2Tai tionilokloridin läsnä ollessa, Socl2, suolahappo ja lämpö:
[Cr (H2JOMPIKUMPI)6] Cl3 + 6SOCL2 + ∆ → crcl3 + 12 HCl + 6SO2
Vaihtoehtoisesti CRCL3 Kloorikaasu saadaan kromin ja hiilioksidin seoksella.
Cr2JOMPIKUMPI3 + 3 c +cl2 => 2 CRCL3 + 3 co
Ja lopuksi, koska se on eniten käytetty menetelmä, se on lämmittää oksidia halogeenisellä aineella, kuten hiilitetrakloridilla:
Cr2JOMPIKUMPI3 + 3ccl4 + ∆ → 2crcl3 + 3COCL2
Sovellukset
Teollisuuden edustajat
Kromikloridi puuttuu kromikloridin (II) on -paikan valmistukseen; Reagenssi, joka puuttuu alkyylihalogenidien vähentämiseen ja (e) -salquenilon haluroiden synteesiin.
Voi palvella sinua: natriumoksalaatti (NA2C2O4): rakenne, ominaisuudet, käytöt, riskit-Sitä käytetään kromoidussa tekniikassa. Tämä koostuu talletuksesta galvanoplastian kautta hienosta kromikerroksesta metalliesineisiin tai muuhun materiaaliin, jolla on koristeellinen tavoite, mikä lisää korroosionkestävyyttä ja myös pinnan kovuutta.
-Sitä käytetään tekstiilimuodona, joka toimii linkinä värjäysmateriaalin ja värjäytyneiden kankaiden välillä. Lisäksi sitä käytetään katalysaattorina olefiinien ja vedeneristysaineiden tuotantoon.
Terapeuttiset lääkkeet
USP -kromikloridilisäaineiden käyttöä suositellaan potilaille, jotka saavat vain laskimonsisäisiä ratkaisuja, joita annetaan kokonaiselle parenteraaliselle ravitsemukselle (TPN). Siksi vain kun nämä potilaat eivät saa kaikkia ravitsemusvaatimuksiaan.
Kromi (III) on osa glukoositoleranssitekijää, insuliinilla edistävien reaktioiden aktivaattori. Uskotaan, että kromi (III) aktivoi glukoosin, proteiinien ja lipidien aineenvaihdunnan, mikä helpottaa insuliinin vaikutusta ihmisillä ja eläimillä.
Kromia on läsnä lukuisissa elintarvikkeissa. Mutta sen pitoisuus ei ylitä 2 annoksella, parsakaali on ruoka, jolla on suurin panos (11 ug). Lisäksi kromin suoliston imeytyminen on alhainen, arvo 0,4 - 2,5% nieltymäärästä.
Tämä vaikeuttaa ruokavalion luomista kromien tarjontaan. Vuonna 1989 Kansallinen tiedeakatemia suositteli välillä 50-200 µg/päivä riittävänä kromin saannina.
Riskejä
Tämän suolan kulutuksen mahdollisista riskeistä kromilisäaineena ovat:
-Vahvat vatsakivut.
-Epänormaali verenvuoto, joka voi vaihdella vaikeuksista parantaa haava, punaiset farsies- tai sisäisen verenvuodon ulostetuotteen tummeneminen.
-Ruoansulatusjärjestelmän ärsytykset aiheuttavat mahahaavoja tai suolistoa.
-Ihotulehdus
Viitteet
- Shiver & Atkins. (2008). Epäorgaaninen kemia. (Neljäs painos). MC Graw Hill.
- Wikipedia. (2019). Kromi (III) kloridi. Haettu: vuonna.Wikipedia.org
- Kromi (III) kloridi [PDF]. Palautettu: alfa.Kemia.Sateen.Edu
- Pubchem. (2019). Kromikloridiheksahydraatti. Toipunut: Pubchem.NCBI.Nlm.NIH.Hallitus
- Kansallinen terveysinstituutti. (21. syyskuuta 2018). Kromi: Ruokavalion lisätietolomake. Haettu: SDG.Od.NIH.Hallitus
- Tomlinson Carole a. (2019). Kromikloridin sivuvaikutukset. Leaf Group Ltd. Toipunut: terveellisesti.com
- « Miksi on tärkeää lukea? 10 lukemisen etuja
- Borax -historia, rakenne, ominaisuudet, käytöt, synteesi, riskit »

