Borax -historia, rakenne, ominaisuudet, käytöt, synteesi, riskit

- 3254
- 305
- Kelly Kilback
Hän Boraksi tai natriumboraatti Se on nimellisryhmä kemiallisille yhdisteille, joilla on NA: n emäskaava2B -4JOMPIKUMPI7. Se on hygroskooppinen suola, joka kykenee muodostamaan lukuisia hydraatteja, rakenteellisesti rikastuttamisen lisäksi tiettyjen metallihäiriöiden läsnäololla.
Tärkeimmät yhdisteet, joita kutsutaan boraxiksi, ovat seuraavat: anhydro -natriumtetraboraatti, na2B -4JOMPIKUMPI7; Pentahydraatti -natriumtetraboraatti (Na2B -4JOMPIKUMPI7-A.5H2JOMPIKUMPI; ja natriumtetraboraatti, na2B -4JOMPIKUMPI7.10H2Tai tai sen vastaava, oktoydraatti natriumtetraboraatti, na2B -4JOMPIKUMPI5(VAI NIIN)4.8h2JOMPIKUMPI.
 Boraksifragmentti. Lähde: Leon Hupperichs [CC BY-SA 3.0 (https: // creativecommons.Org/lisenssit/by-SA/3.0)]
Boraksifragmentti. Lähde: Leon Hupperichs [CC BY-SA 3.0 (https: // creativecommons.Org/lisenssit/by-SA/3.0)] Kuten voidaan nähdä, kaikki aiemmat kiinteät aineet eroavat toisistaan vain niiden nesteytysasteessaan; Joidenkin kiteissä on enemmän vesimolekyylejä kuin toisilla. Fyysisesti booraksi on samanlainen kuin kappaleet tai vankka liitukiteet (ylivoimainen kuva).
Luonnollisesti booraksia löytyy kausiluonteisten järvien sedimenteistä, kuivattu haihduttaminen. Boraxia esiintyy Turkissa, Searles Lakes (Kalifornia), Atacamassa, Chilessä, Bolivia, Tiibet ja Romania Desert. Synteettisesti booraksikiteitä voidaan saada hitaan ytimenmuodostusprosessin kautta; eli yksi, jossa kiteiden kasvua suositaan.
Natrium, vedettömät ja rappeutuneet tetrabortit ovat vähän liukenevia kylmään veteen; mutta sen liukoisuus kasvaa lämpötilan noustessa. Sitten eräs2B -4JOMPIKUMPI7.10H2Tai se on erittäin liukoinen eteeniglykoliin, kohtalaisen liukenee etanoliin ja liukenee vähän asetoniin; Nämä ovat vähemmän polaarisia liuottimia kuin vesi.
Boraxilla on lukuisia sovelluksia, kuten pesuaineiden ja saippuan kehittämisessä; selluloosimateriaalin tulipalon viivästyjänä; lasikuitutuotannossa; kovien pintojen, kuten metallien, lasin ja keramiikan, puhdistamisessa; ja korroosion esto, muun muassa.
Borax ärsyttää silmiä, ihoa ja hengitystiloja. Nielemällä se voi tuottaa muun muassa oireiden, oksentelun, ripulin, roikkumisen, rappeutumisen ja kouristusten oireiden kanssa. Tällä hetkellä epäillään, että haitallisia vaikutuksia ihmisen lisääntymiseen voi olla.
[TOC]
Historia
Boraxin historia on hämmentävä. On huomautettu. Se siirrettiin Tiibetin seitsemäntenä vuosisadalla Saudi -Arabiaan niin kutsutun silkkireitin jälkeen.
Termi "borax" oli suosittu lukuisten sovellusten jälkeen, joita löydettiin ja markkinoidaan nimellä 20 Mule Team Borax Tradermax, joka viittasi tapaan, jolla boraksi kuljetettiin Nevadan ja Kalifornian autiomaiden läpi.
Toinen heidän löytönsä versio osoittaa, että egyptiläiset olivat tunteneet olemassaolostaan pitkään, käyttämällä sitä metallihitsauksissa lämmöllä. Lisäksi he käyttivät sitä lääketieteessä ja mumifikaatioprosessissa. Marco Polo siirsi Boraxin Eurooppaan 13. vuosisadalla.
Magove -autiomaasta löydettiin suuria booraksi -talletuksia, jotka tekivät sen käytöstä siitä lähtien, vuosisadan puolivälissä.
Booraksirakenne
 Boraksi -ionirakenne. Lähde: Smokefoot [CC BY-SA 4.0 (https: // creativecommons.Org/lisenssit/by-SA/4.0)]
Boraksi -ionirakenne. Lähde: Smokefoot [CC BY-SA 4.0 (https: // creativecommons.Org/lisenssit/by-SA/4.0)] Ylivoimainen kuva näyttää ionit, jotka muodostavat booraksin, joka vastaa erityisesti kiinteää kiinteää koostumuskaavaa NA: sta2[B4JOMPIKUMPI5(VAI NIIN)4] · 8H2Tai (tai na2B -4JOMPIKUMPI7· 10H2JOMPIKUMPI).
Ensinnäkin anionin häkki rakenne voidaan huomata [B4JOMPIKUMPI5(VAI NIIN)4-2- (Vaikka minulla pitäisi olla kaksi ryhmää-), jossa voidaan nähdä kahdeksankulmainen rengas (neljä b ja neljä O: ta), kun B-O-B-silta jakaa sen kahteen puoliskoon.
Voi palvella sinua: emäksiset ratkaisut: Määritelmä, ominaisuudet ja käytötTämä häkki ei pysy staattisena, vaan värähtelee ja hyväksyy avaruudessa erilaisia konformaatioita; Kuitenkin vähemmässä määrin sillan läheisyydessä. Voidaan myös huomata, että se on hyvin "hapetettu"; Toisin sanoen siinä on monia happiatomeja, jotka kykenevät vuorovaikutukseen vesimolekyylien kanssa vety silloilla.
Ei ole yllättävää, että borax -kiteet voivat hydroitua ja tuottaa lukuisia hydraatteja. Siten kiinteä NA: lle2[B4JOMPIKUMPI5(VAI NIIN)4] · 8H2Tai on kahdeksan H -molekyylejä2Tai vuorovaikutuksessa boraraattihäkin kanssa ja samalla NA: n metallikeskusten kanssa+.
Kationin puolella sinulla on vesikompleksi [na (h2JOMPIKUMPI)4-+n, Jos n: n arvo riippuu anionin/kationin osuudesta. Yläosassa, n = 2, joten sinulla on: [na2(H2JOMPIKUMPI)8-2+, joiden kuorma 2+ neutraloi boraraatti-anionin 2-.
Kiteet
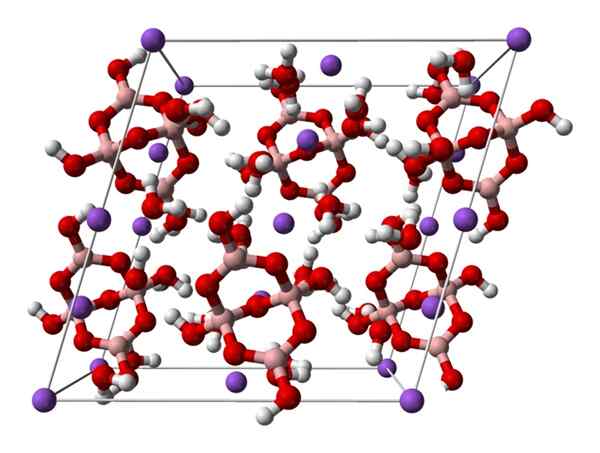 Booraksin monokliininen solu. Lähde: Ben Mills [julkinen
Booraksin monokliininen solu. Lähde: Ben Mills [julkinenVerkkotunnus].
Ylöspäin2[B4JOMPIKUMPI5(VAI NIIN)4] · 8H2Tai tai na2B -4JOMPIKUMPI7· 10H2JOMPIKUMPI. Tässä sähköstaattiset nähtävyydet ja vety sillat hallitsevat tai hallitsevat rakenteellisia kuvioita, jotka on peräisin jokaisesta lasin lasista.
Muut hydraatit ja vedetön suola menettävät yhden tai kaikki niiden vesimolekyylit muuttaen booraksikiteitä koostumusta ja rakennetta. Kaikissa niissä anioni ja kationi pysyvät samoina (ellei epäpuhtauksia tai sivuttaisia reaktioita), joten sekaannusta ei voida luoda.
Sekaannuksia borato -anionin kanssa
Naa2[B4JOMPIKUMPI5(VAI NIIN)4] · 8H2Tai ja na2B -4JOMPIKUMPI7· 10H2Tai ne ovat samoja. Koska?
Ensinnäkin, jos heidän atomit lasketaan, he näkevät, että ne ovat yhtä mieltä lukumäärästä; Ja toiseksi, anionissa B4JOMPIKUMPI72- Kahden OH-ryhmän puuttuminen, jotka on kytketty B-O-B-siltojen boorin päähän; Kaksi oi, yhdessä kahden H: n kanssa+ B: stä4JOMPIKUMPI72-, Lisää jopa 2 tuntia2Tai antaen yhteensä 10 tuntia2O (8 + 2).
Ominaisuudet
Nimeä
- Booraksi.
- Natriumboraraatti.
- Natriumtetraboraatti.
- Datoriable -tetraboroitu.
Molekyylimassa
Anhydro: 201,22 g/mol.
Dekohydraatti: 381,38 g/mol.
Fyysinen ulkonäkö
Kiteinen valkoinen kiinteä aine.
Tiheys
Vedetön: 2,4 g/cm3
Decahriquure: 1 739 g/cm3
Sulamispiste
Anhidro: 743 ºC (1.369 ºF, 1.016 k).
Decohydraatti: 75 ºC.
Kiehumispiste
Anhidro: 1.575 ºC (2.867 ºF, 1.848 K).
Vesiliukoisuus
31,78 g/l (molemmat vedettömälle ja rappeutuneelle).
Liukoisuus orgaanisiin liuottimiin
Se on erittäin liukoinen eteeniglykoliin, liukenee kohtalaisesti dietyleeniglykoliin ja metanoliin ja liukenee hieman asetoniin.
Taiteindeksi (ηD)
Anhidro: η1 = 1 447; η2 = 1 469.
Decayedrado: η2 = 1 472.
Vakaus
Se on vakaa riittävässä varastointiolosuhteessa. Vaikka sillä on alhainen höyrynpaine, se kasvaa lämpötilan myötä, aiheuttaen kiteytymistä ja kondensaatioita, joten liiallista lämpötilaa ja kosteuden vaihtelua tulisi välttää.
Kevyt päästö
Natriumtetraboraatti, kun palonvaikutus altistetaan, säteilee vihreää valoa.
Reaktiot
- Kun liukenevat veteen, alkaliset liuokset ovat peräisin pH: lla noin 9,2.
- Borax reagoi muihin boratteihin, kuten perboraatti (PBS).
- Se tuottaa myös boorihappoa reagoidessaan suolahapon kanssa:
Naa2B -4JOMPIKUMPI7· 10H2O + hcl => 4 h3Bo3 + 2 na NA+ + 2 Cl- + 5 h2JOMPIKUMPI
- Natriumtetraboraatti käyttäytyy amfohete -aineeksi, koska vesiliuoksessa se hydrolysoituu ja kykenee neutraloimaan happoa. Samoin se kykenee neutraloimaan korkean pitoisuuden alkalin välttäen väliaineen pH: n liiallisen korkeuden.
Voi palvella sinua: Ensisijainen alkoholi: rakenne, ominaisuudet, nimikkeistö, esimerkitSovellukset
Boraxilla on lukuisia sovelluksia sekä ihmisen että sen suorittamien toimintojen joukossa.
Antioksidanttivaikutus
Boraxilla on kyky liuottaa oksideja. Tästä syystä sitä käytetään metallien, kuten messinki, kuparin, lyijyn ja sinkin, palautumisessa.
Sitä käytetään myös metallipalkkien hapettumisen estämiseen säätiöissä. Borax kattaa sen pinnan, lukuun ottamatta ilmaa ja siksi välttää hapettumista. Lisäksi se estää rautamateriaalin korroosion autonvalmistuksessa.
Borax -liukoisuus eteenin glykolissa on ollut hyödyllinen jäätymisenestoaineiden formulaatioissa. Borax neutraloi happamat jätteet, jotka tuotetaan eteeni -glykolin hajoamisen aikana, minimoimalla metallien pinta hapettumisen.
Liimojen kehittäminen
- Borax on osa aaltopaperin ja pahvin tarttuvaa tärkkelysformulaatiota.
- Se on peptisoiva aine kaseiiniin ja dekstriiniin perustuvien liimojen valmistuksessa.
- Toimii liima -aineiden vahvistamista ylittämällä konjugoidut hydroksiiliryhmät.
Palonestoaine
Sitä käytetään palonestoaineena selluloosa -materiaaleissa ja muissa hydroksilisryhmissä sisältävissä polymeereissä. Se käyttää vaikutustaan useiden mekanismien kautta, mukaan lukien lasimaisen kerroksen muodostuminen, joka rajoittaa polttoaineiden pääsyä.
Borosilisoitu lasi -kehitys (Pyrex)
Borax on boorin lähde, jota käytetään borosiloidun lasin kehittämisessä; jolle on tunnusomaista korkea fuusiopiste, alhainen laajenemiskerroin ja korkea vastus lämpöiskuille.
Tämän avulla voit olla korkeita lämpötiloja ilman murtumia, vastaanottamalla tulenkestävän lasin nimeämisen.
Borosiloitua lasia käytetään kotona käytettävien materiaalien kehittämisessä ruoan leipomiseen. Sitä käytetään myös laboratoriossa dekantterilasi, fixolas, mittaa sylinterit, pipetit jne.
Emulgointiaine
Boraxia yhdessä muiden yhdisteiden kanssa käytetään saippuan ja muiden parafiinien emulgointiin. Sitä käytetään myös perustana voiteiden, voiteiden ja voiteiden kehittämiselle.
Puhdistusmateriaali
- Sitä lisätään formulaatioihin tiukan pinnan, kuten metallien, lasin ja keramiikan, puhdistamiseksi.
- Sitä käytetään kädenpuhdistusaineissa, kiillotusmateriaalissa ja pesuaineiden saippuat pesulissa ja kodissa. Lisäksi se helpottaa öljyisten kerrostumien poistamista tehtaiden lattioista.
Lääketieteelliset käyttötarkoitukset
- Sitä käytetään jalkojen sieni -infektioiden hoidossa.
- Se on osa ravintoainekaavaa, joka toimittaa booria. Tämän elementin ajatellaan puuttuvan kalsium-, fosforin ja magnesiummetaboliaan, joka on välttämätöntä luun rakenteeseen.
- Se puuttuu glykosyloidun hemoglobiinin (HBA1C) määrittämiseen, joka on todiste, joka tietää pitkän aikavälin diabeteksen kehittymisen potilaalla, koska punasolujen puoliikäinen aika on 120 päivää 120 päivää.
Nämä tiedot ovat hyödyllisempiä lääkärille kuin potilaan verensokerin eristetyt määritykset.
PH -iskunvaimennin
Sitä käytetään useissa biokemiassa käytetyissä pH -iskunvaimentimissa; Niistä tris (hydroksimetyyli) aminometaani-boray, jota käytetään elektroforeesissa DNA: n ja RNA-nukleiinihappojen polyakryyliamidissa.
Veden kovuuden väheneminen
Borax pystyy yhdistymään vedessä läsnä olevien kalsiumin ja magnesiumionien kanssa vähentäen sen pitoisuutta. Tällä tavoin veden kovuus vähenee.
Voi palvella sinua: kaliumhydroksidi: rakenne, ominaisuudet, käyttötarkoituksetLannoite ja lannoite
Boraxia käytetään boorin lähteenä. Kalsium ja boori ovat mukana kasvien soluseinämän muodostumisessa. Lisäksi on huomautettu.
Puisten säilyttäminen
Borax taistelee Woodwoodia, kovakuoriaista, joka kuluttaa ja tuhoaa puuta. Sitä käytetään myös puulaivojen säilyttämisessä ja ylläpidossa.
Perustaminen ja virtaus
Sitä käytetään perustajana teräs- ja rautahitsauksessa, mikä aiheuttaa sulamispisteen vähenemistä ja rautaoksidin eliminointia; Ei -toivottu epäpuhtaus. Samankaltaisella päässä se osallistuu kullan ja hopean hitsaukseen.
Toiset
- Sitä käytetään pehmeänä torjunta -aineena; Esimerkiksi koiten taistelu villassa.
- Suihkutettua tarjoillaan kaapissa olevien tuholaisten, sisäisten kerrostumien, seinien aukkojen ja yleensä, joissa saastuttavien torjunta -aineiden käyttöä ei ole toivottu.
- Sitä käytetään ydinreaktoreissa reaktioiden hallintaan, jotka voisivat tuottaa äärimmäisissä tapauksissa ketjureaktiota.
- Autojen jäähdyttimissä Boraxia käytetään saamaan sivustot, joissa vettä on paeta.
Synteesi
Borax saadaan reagoivasti5JOMPIKUMPI9.8h2Tai natriumkarbonaatilla ja natriumhortokarbonaatilla vesipitoisessa väliaineessa.
Oikeastaan natrium- tai borax -tetraboraatin synteesiä käytetään vähän; Suurin osa tuotetusta yhdisteestä saadaan sen sisältävien mineraalien uuttamalla.
Prosessi voidaan tiivistää malmin liuoksessa vedessä, mitä seuraa savisuodatus ja lopulta vesiliuoksen haihtuminen.
Riskejä
Borax on luonnollinen tuote, mutta se voi tuottaa sarjan terveysvaurioita ihmisillä. Esimerkiksi pölypölyn kanssa kosketuksista johtuen ihon ärsytys voi aiheuttaa ihontulehdusta.
Samoin Borax aiheuttaa silmien ärsytystä ja ylähengitysteitä. Hengityksen oireiden joukossa on yskä ja kurkkukipu.
Samaan aikaan Borax. Lisäksi voi tapahtua keskushermoston ja munuaisten toiminnan vaikutusta.
Mies -sukupuolen rotissa suoritetuista tutkimuksista, joita syötettiin booraksilla, havaittiin kiveksen atrofia. Vaikka raskaana olevien naisrottien kanssa tehdyt tutkimukset huomauttivat, että boraksi voisi ylittää istukan, tuottaen sikiön kehityksen muutoksen, joka ilmenee alhaisella syntymäpainolla.
Uskotaan, että borax -altistuminen voi vaikuttaa miesten lisääntymistoimintaan ihmisessä, mikä ilmenee siittiöiden laskennan vähentymisen myötä.
Aikuisten booraksin saannin arvioidaan kohtalokas annos 10 - 25 grammaa.
Viitteet
- Shiver & Atkins. (2008). Epäorgaaninen kemia. (Neljäs painos). MC Graw Hill.
- Kansallinen bioteknologiatietojen keskus. (2019). Argoni. Pubchem -tietokanta. CID = 23968. Toipunut: Pubchem.NCBI.Nlm.NIH.Hallitus
- Karolyn Burns, Seneca Joseph ja Dr. Ryan Baumbach. (S.F.-A. Borax -kiteiden ja metallilisten seosten synteesi ja ominaisuudet. Toipunut: NationalMaglab.org
- Wikipedia. (2019). Booraksi. Haettu: vuonna.Wikipedia.org
- Rio Tinto. (2019). Booraksin dehydraatti. 20 Mule Team Borax. Palautettu: Borax.com
- Fletcher Jenna. (14. tammikuuta 2019). Onko boraksi turvallista käyttää? Toipunut: MedicalNewstody.com
- « Kromikloridi (CRCL3) rakenne, ominaisuudet, käytöt
- Siirtogeeniset ruoan ominaisuudet, edut, esimerkit, seuraukset »

