Tinakloridi (II)
- 3852
- 1167
- Eddie Hackett
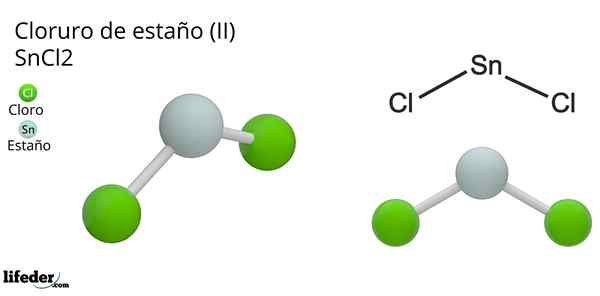
Hän Tinakloridi (Ii) tai pieni kloridi, kemiallinen kaava SNCL2, Se on valkoinen ja kiteinen kiinteä yhdiste, tina -reaktion tuote ja konsentroitu suolahappoliuos: SN (S) + 2HCL (CONC) => SNC2(aq) + h2(g). Synteesiprosessi (valmiste) koostuu tinapalojen lisäämisestä reagoimaan hapon kanssa.
Tinapalojen lisäämisen jälkeen dehydraatio ja kiteytyminen suoritetaan, kunnes epäorgaaninen suola saadaan. Tässä yhdisteessä tina on menettänyt kaksi elektronia valenssikerroksestaan muodostaakseen yhteydet klooriatomiin.
Tämä voidaan ymmärtää paremmin, otetaan huomioon tina Valencia -kokoonpano (5s25 px2pja0 -pz -z0 -), joista kiertoradan p: n elektroniparix on osoitettu protoneille H+, Diatomisen vetymolekyylin muodostamiseksi. Eli tämä on redox -tyyppinen reaktio.
[TOC]
Tinakloridiominaisuudet
 Tinakloridi (II) dihydraatti
Tinakloridi (II) dihydraatti SNCL -linkit2 Ne ovat ionisia tai kovalenttisia tyyppejä? Tinkloridin fysikaaliset ominaisuudet (ii) hävitä ensimmäinen vaihtoehto. Tämän yhdisteen fuusio- ja kiehumispisteet ovat 247 ºC ja 623 ºC, mikä viittaa heikkoihin molekyylien välisiin vuorovaikutuksiin, yleinen tosiasia kovalenttisille yhdisteille.
Hänen kiteensä ovat valkoisia, mikä tarkoittaa nolla -absorptiota näkyvässä spektrissä.
Valencia -kokoonpano
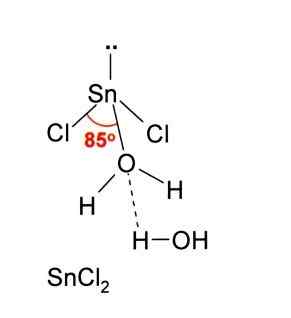
Yllä olevassa kuvassa havainnollistetaan eristetty snick -minttu2.
Molekyyligeometrian tulisi olla tasainen, koska keskusatomin hybridisaatio on SP2 (3 SP -kiertorataa2 ja puhdas Prbital kovalenttisten sidosten muodostamiseksi), mutta elektronitön vääntömomentti vie tilavuuden ja työntää klooriatomeja alaspäin, mikä antaa molekyylille kulmageometrian.
Kaasufaasissa tämä yhdiste on eristetty, joten se ei ole vuorovaikutuksessa muiden molekyylien kanssa.
Voi palvella sinua: saponifikaatioElektroniparin menetyksenä kiertoradalla px, Tina muuttuu SN -ioniksi2+ ja sen tuloksena oleva sähköinen kokoonpano on 5s25 px0 -pja0 -pz -z0 -, Kaikkien lajien linkit hyväksymään kaikki orbitaalit.
Cl -ionit- Ne koordinoivat SN -ionin kanssa2+ Tinkloridin aiheuttaminen. Elektroninen tinakokoonpano tässä suolassa on 5s25 px2pja2pz -z0 -, Mahdollisuus hyväksyä toinen elektronipari ilmaisessa Orbital P: ssäz -z.
Voit esimerkiksi hyväksyä toisen ionin-, Trigonaalisen litteän geometriakompleksin (kolmion muotoinen emäs pyramidi) ja negatiivisesti ladattu [SNCL3--.
Reaktiivisuus
Sncl2 Sillä on korkea reaktiivisuus ja suuntaus käyttäytyä Lewis Acid (elektronireseptorina) Valencia Octet -sovelluksen suorittamiseksi.
Samoin kuin ioni Cl-, Sama koskee vettä, joka "hydroi" tina -atomi, kun vesimolekyyli on kytketty suoraan tinaan, ja toinen vesimolekyyli muodostaa vuorovaikutukset vety silloilla ensimmäisen kanssa.
Tämän tuloksena on, että SNCL2 Se ei ole puhdasta, mutta koordinoitu veden kanssa sen dihydratoitussa suolassa: SNCL2· 2h2JOMPIKUMPI.
Sncl2 Se on erittäin liukoinen vesi- ja polaarisiin liuottimiin, koska se on polaarinen yhdiste. Sen veden liukoisuus, vähemmän kuin massapaino, aktivoi kuitenkin hydrolyysireaktion (vesimolekyylin repeämä) emäksisen ja liukenemattoman suolan tuottamiseksi:
Sncl2(aq) + h2Tai (l) sn (OH) cl (s) + hcl (aq)
Kaksinkertainen nuoli osoittaa, että tasapaino on vahvistettu, suosittu vasemmalle (reagensseja), jos HCL -pitoisuudet kasvavat. Siksi SNCL -ratkaisut2 Työntekijöillä on hapan pH, jotta vältetään hydrolyysin ei -toivotun suolatuotteen saostuminen.
Se voi palvella sinua: nukleofiili: nukleofiilinen hyökkäys, tyypit, esimerkit, nukleofiilisyysPelkistävä toiminta
Reagoi ilman hapen kanssa tinakloridin (IV) tai kloridin muodostamiseksi:
6 SNCL2(aq) + o2(g) + 2h2Tai (l) => 2sncl4(aq) + 4sn (OH) Cl (s)
Tässä reaktiossa tina hapettaa muodostaen yhteyden elektronegatiiviseen happiatomiin ja lisää sen sidosten lukumäärää klooriatomien kanssa.
Yleisesti2 on pelkistävä aine.
Hapettuna ja menettää kaikki valenssielektronit, SN -ioni4+ on 5S -kokoonpano0 -5 px0 -pja0 -pz -z0 -, Viiden kiertoradan elektronipari on vaikein "ottaa pois".
Tinakloridin kemiallinen rakenne
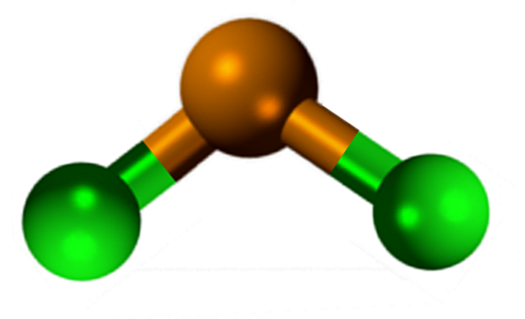 Tinakloridirakenne (II)
Tinakloridirakenne (II) Sncl2 Siinä on ortorromisen tyypin kiteinen rakenne, joka on samanlainen kuin Serruchos -rivit, joissa hampaiden kärjet ovat klorideja.
Jokainen rivi on SNCL -ketju3 CL-sillan muodostaminen toisella SN-atomilla (CL-SN (CL)2-Cl- ···). Kaksi ketjua yhdessä SN-CL-tyypin heikkojen vuorovaikutusten kanssa muodostavat järjestelyn kerroksen, joka on päällekkäinen toisen kerroksen yli, ja niin edelleen, kunnes kiteisen kiinteän aineen määritteleminen.
Ilmainen elektronipari 5s2 Aiheuttaa vääristymiä rakenteessa, koska se vie tilavuuden (elektronisen pilven tilavuus).
SN: llä voi olla yhdeksän yhtä suurta koordinaatioluku, joka on sama kuin yhdeksän naapurin naapuria, jotka piirtävät trigonaalisen prisman, joka sijaitsee geometrisen hahmon keskellä ja kärjessä kussakin, muiden CL: n lisäksi, joka sijaitsee kussakin CL: ssä prisman neliömäiset kasvot.
Voi palvella sinua: HydrceTätä on helpompi tarkkailla, pidetäänkö sitä ketjuna, jossa SN (tummanharmaa pallot) osoittavat, ja kolme CL: tä kytkettynä tähän kolmion lattiaan, kun taas kolme asiakasta muodostavat ylemmän kolmionmuotoisen katon.
Käyttää/sovelluksia
Orgaanisessa synteesissä sitä käytetään aromaattisten nitroyhdisteiden pelkistävänä aineena (AR-ei2 à ar-nh2-A. Koska sen kemiallinen rakenne on laminaarinen, se löytää käyttöä orgaanisten reaktioiden katalyysin maailmassa potentiaalisen ehdokkaan lisäksi katalyyttinen tuki.
Sen pelkistävää ominaisuutta hyödynnetään kultayhdisteiden läsnäolon määrittämiseksi, lasin peittämiseksi hopeapeileillä ja antioksidanttina toimimaan.
Myös molekyyligeometriassa trigonaalinen pyramidi (: SNX3- M+) käytetään Lewis -emäksenä laajan määrän yhdisteiden synteesiä varten (kuten PT -klusterikompleksi3Sn8Clkaksikymmentä, missä elektronitön pari on koordinoitu Lewis -hapon kanssa).
Riskejä
Sncl2 Voit vahingoittaa valkosoluja. Se on syövyttävä, ärsyttävä, karsinogeeninen, ja sillä on suuria negatiivisia vaikutuksia lajeihin, jotka asuvat meren ekosysteemejä.
Voi hajota korkeissa lämpötiloissa vapauttamalla haitallista kloorikaasua. Kosketuksessa erittäin hapettavien aineiden kanssa laukaisee räjähtäviä reaktioita.
Viitteet
- Shiver & Atkins. (2008). Epäorgaaninen kemia. Sisään Ryhmän 14 elementit (Neljäs painos., p. 329). MC Graw Hill.
- Kemikaalikirja. (2017). Chemicalbook: Chemicalbook.com
- Pubchem. (2018). Tinakloridi. Pubchem palautettu: Pubchem.NCBI.Nlm.NIH.Hallitus
- Wikipedia. (2017). Tina (ii) kloridi. Wikipedia toipui: vuonna.Wikipedia.org
- F. Ruuhka. (1976). Kerrostyyppisten vaiheiden rakennekemia. P-120,121. D -d. Reidel Publishing Company.

