Rautakloridi (III) rakenne, ominaisuudet, hankkiminen, käyttö
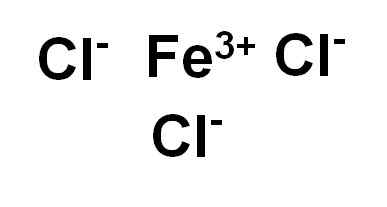
- 1999
- 617
- Gustavo Runte DVM
Hän Rautakloridi (III) Se on epäorgaaninen yhdiste, jonka muodostaa rauta (usko) ja kloorielementit (CL). Sen kemiallinen kaava on FECL3. Se on kiteinen kiinteä aine, jonka väri voi olla oranssista mustanruskeaan.
FECL3 Se on helposti liuennut veteen muodostaen happamia vesiliuoksia, joissa lisäämällä pH: ta tekemällä niistä alkalisempia.
 Rautakloridi (III) tai ferrikloridi FECL3 kiinteä. Еор оин/cc by-SA (https: // creativecommons.Org/lisenssit/by-SA/3.0). Lähde: Wikimedia Commons.
Rautakloridi (III) tai ferrikloridi FECL3 kiinteä. Еор оин/cc by-SA (https: // creativecommons.Org/lisenssit/by-SA/3.0). Lähde: Wikimedia Commons. Raudan kloridia (III) käytetään sedimenttien sedimenttiä, jotka saastuttavat kunnan tai teollisuuden jätevettä. Sanotaan.
Se palvelee kuparisulfidimineraalien kuparia (II). Sitä käytetään myös erilaisissa kemiallisissa reaktioissa ja biologisten ja kemiallisten laboratorioiden analysoinnissa. Esimerkiksi se käyttää yhdisteiden havaitsemista fenoleina kasveista uutetuissa öljyissä. Sitä käytetään elektronisissa piireissä, nahkaparannerissa ja valokuvauksessa.
FECL: n olemisesta3 Happoyhdiste on syövyttävä iholle ja limakalvoille. Tämän yhdisteen pölyä on vältettävä. Sitä ei pidä hylätä ympäristölle.
[TOC]
Rakenne
Rautakloridi (III) tai ferrikloridi FECL3 Se on ioninen yhdiste ja muodostuu rauta -usko3+ ja kolme ionikloridia CL-. Rauta on sen hapetustilassa +3 ja jokaisella kloorilla on Valencia -1.
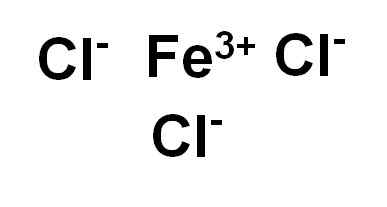 Rautakloridi (III) tai ferrikloridi. Kirjoittaja: Marilú Stea.
Rautakloridi (III) tai ferrikloridi. Kirjoittaja: Marilú Stea. Nimikkeistö
- Rautakloridi (III)
- Ferrikloridi
- Rautatrikloridi
- Rauta- muriatuuri
Ominaisuudet
Fyysinen tila
Kiteinen kiinteä oranssi ja mustanruskea.
 Ferrikloridi FECL3 vedetön (ilman vettä). Leiem/CC BY-SA (https: // creativecommons.Org/lisenssit/by-SA/4.0). Lähde: Wikimedia Commons.
Ferrikloridi FECL3 vedetön (ilman vettä). Leiem/CC BY-SA (https: // creativecommons.Org/lisenssit/by-SA/4.0). Lähde: Wikimedia Commons. Molekyylipaino
Anhidro fecl3 = 162,2 g/mol
Sulamispiste
Anhidro fecl3 = 304 ºC
Heksahydraatti fecl3 •6H2O = 37 ° C
Kiehumispiste
Anhidro fecl3 = Noin 316 ºC
Heksahydraatti fecl3 •6H2O = 280-285 ° C
Tiheys
Anhidro fecl3 = 2,90 g/cm3 25 ° C: ssa
Liukoisuus
Hyvin liukoinen veteen: 74,4 g/100 g vettä 0 ° C: ssa; 535,7 g/100 g vettä 100 ° C: ssa. Hyvin liukoinen asetoniin, etanoliin, eetteriin ja metanoliin. Liukenevat heikosti ei -polaarisiin liuottimiin, kuten bentseeniin ja heksaaniin.
Voi palvella sinua: boori: historia, ominaisuudet, rakenne, käyttötarkoituksetPHE
Sen vesiliuokset ovat hyvin happamia. Liuos 0,1 moolia FECL: tä3 Litraa kohti vettä on pH 2,0.
Kemialliset ominaisuudet
Kun fadl liukenee veteen3 Se on hydrolysoitu; toisin sanoen se erottuu uskossaan ioneissa3+ ja 3 cl-. Usko3+ muodostaa heksaacuohierro -ionin [usko (h2JOMPIKUMPI)6-3+ Mutta tämä yhdistetään OH -ioneihin- vettä muodostaen sekoitettuja lajeja ja vapauttavat protonit H+.
Tästä syystä niiden liuokset ovat happamia. Jos pH nousee, nämä lajit muodostavat geelin ja lopulta muodostuu sakka tai kiinteä ferrioksidi -usko2JOMPIKUMPI3 •Nh2JOMPIKUMPI.
Rautakloridikiteitä (III) ovat hygroskooppisia, ts. Ne imevät vettä ympäristöstä. Kun se on märkä, se on syövyttävää alumiinille ja monille metalleille.
 FECL -ratkaisut3 Ne voivat olla hyvin happamia ja syövyttäviä, koska ne sisältävät HCL: ää. Kanesskong/cc by-Sa (https: // creativecommons.Org/lisenssit/by-SA/4.0). Lähde: Wikimedia Commons.
FECL -ratkaisut3 Ne voivat olla hyvin happamia ja syövyttäviä, koska ne sisältävät HCL: ää. Kanesskong/cc by-Sa (https: // creativecommons.Org/lisenssit/by-SA/4.0). Lähde: Wikimedia Commons. FECL -vesiliuokset3 Ne ovat erittäin happamia ja syövyttäviä useimmille metalleille. Niillä on heikko hcl -suolahapon haju. Kun FECL lämmitetään sen hajoamiseen asti3 säteilee erittäin myrkyllisiä HCL -kaasuja.
Saada
Raudan kloridia (III) tuotetaan raudan suora klooraus uudelleen reagoimalla kuivakloori (Cl2) Rauta romu (usko) 500-700 ° C: ssa.
Reaktio suoritetaan happoresistentissä reaktorissa. Ensimmäinen askel on sulaa 600 ° C: ssa rautakloridin (III) seos (FECL3) ja kaliumkloridi (KCL).
 FECL3 Se on valmistettava säiliöissä, jotka ovat erittäin kestäviä happojen, kuten ruostumattomasta teräksestä. Kirjoittaja: Johannes Plenio. Lähde: Pixabay.
FECL3 Se on valmistettava säiliöissä, jotka ovat erittäin kestäviä happojen, kuten ruostumattomasta teräksestä. Kirjoittaja: Johannes Plenio. Lähde: Pixabay. Sitten rauta romu (usko) liuotetaan siihen sulaan seokseen, jossa rauta reagoi FECL: n kanssa3 Ja siitä tulee rautakloridia (FECL2-A.
Fe + 2 FECL3 → 3 FECL2
Sitten FECL2 Reagoi kloorin CL: n kanssa2 FECL: n muodostaminen3 jotka sublimoivat (siirtyy kiinteästä tilasta suoraan kaasumaiseen) ja kerätään erityisissä kondensaatiokammioissa.
2 FECL2 + Cl2 → 2 FECL3
Voit myös reagoida rautafesosulfaatin4 kloorilla CL2.
Heksahydraatti fecl3 •6H2O Se voidaan saada haihduttamalla uskon ionien vesiliuos3+ ja cl- Höyrykylvyssä.
Voi palvella sinua: kvaternääriset yhdisteet: ominaisuudet, koulutus, esimerkitLäsnäolo luonnossa
Ferrikloridi tai rautakloridi (III) löytyy muodossa MO -mineraalin mineraalin muodossa, jota löytyy aktiivisten tulivuoren fumarolien laavasta. Tulivuorista, josta löydät, on vuori Vesubio.
 FECL3 Se on osa moysite -malmia, joka on aktiivisissa tulivuorissa. Kirjoittaja: Skeze. Lähde: Pixabay.
FECL3 Se on osa moysite -malmia, joka on aktiivisissa tulivuorissa. Kirjoittaja: Skeze. Lähde: Pixabay. Sovellukset
Jäteveden hoidossa
Ferrikloridia käytetään kunnallisen tai teollisuuden jäteveden hoitoon kemiallisen sedimentaation avulla.
Se toimii koagulanttina, joka suosii useiden hiukkasten yhdistystä toistensa kanssa, tällä tavalla muodostuu konglomeraatit tai suuremmat hiukkaset, joilla on taipumus flokkuloimaan tai sedimenttiin (alentamalla oman painonsa käsiteltävän veden pohjaan).
 FECL3 Sitä käytetään erottamaan epätoivotut materiaalit yhteisöistä tai teollisuudesta hylkäävistä vesistä. Kirjoittaja: 后园 卓. Lähde: Pixabay.
FECL3 Sitä käytetään erottamaan epätoivotut materiaalit yhteisöistä tai teollisuudesta hylkäävistä vesistä. Kirjoittaja: 后园 卓. Lähde: Pixabay. Tällä tavoin veden erottaminen on suosittu ja siinä ei ole ei -toivottua materiaalia.
Tämäntyyppiset hoidot voivat helpottaa loisten, kuten alkueläinten, poistamista, jotka ovat mikro -organismeja, jotka muodostuu yksi solu, kuten Amibas, jotka aiheuttavat tautia.
Tästä syystä FECL3 Sitä käytetään myös veden puhdistamiseen.
Eläinlääketieteellisissä paranemismenetelmissä
Rautakloridia (III) käytetään eläinvammojen parantamiseen.
Se toimii paikallisena supistavana (voit vetää kudoksia ja toimia anti -inflammatorisena ja paranemisena) ja hemostaattisena (se lopettaa verenvuodon tai verenhäviöt).
Sitä käytetään jauheissa verenhäviöiden lopettamiseksi tai kun hevoset on leikattu nautakarjaan. Sitä käytetään myös liuoksessa verenvuodon lopettamiseksi, kun kynät leikataan tai syylät eliminoidaan.
 FECL3 Sitä käytetään lehmien leikatuissa jauheissa ja välttää tartuntoja. Kirjoittaja: Jaclou DL. Lähde: Pixabay.
FECL3 Sitä käytetään lehmien leikatuissa jauheissa ja välttää tartuntoja. Kirjoittaja: Jaclou DL. Lähde: Pixabay. Sitä käytetään myös nieluntulehduksen (nielun tulehduksen) tai stomatiitin (suun limakalvon tulehduksen) hoitamiseen ja veren hemoglobiinin lisäämiseen joillakin lintuilla.
Metallinpoistossa
Rautakloridi (III) tai ferrikloridi FECL3 Sitä käytetään kuparimalmin kuparin (II) purkamiseen, jotka sisältävät mainitun metallin sulfideja.
Voi palvella sinua: hydroksiditSe on hapettumismenetelmä, joka on riittävä välttämään myrkyllisen kaasun rikidioksidin vapautumista (niin2), koska tämän sijasta syntyy rikki (t). Ratkaisut, joilla on korkeat FECL -pitoisuudet, tuotetaan2, FECL3, Cucl2 ja muut metallikloridit.
4 FECL3 + Cu2S ⇔ 4 FECL2 + 2 cucl2 + S ↓
Kemiallisten ja biologisten laboratorioiden reagenssina
Monien sen kemian käytöstä tulee osoittaa fenoliryhmän läsnäolon (ts. Ryhmä -OH kiinnitetty bentseenirenkaaseen).
Yhdiste on liuennut analysoimaan etanolissa ja lisätään muutama tippa FECL -liuosta3. Kun yhdisteessä on ryhmä -OH, joka on kiinnitetty bentseenirenkaan (ts. Se on fenoli), sinertävä vihreä väri muodostuu.
Tämä testi mahdollistaa fenolien läsnäolon analysoinnin kasviuutteissa.
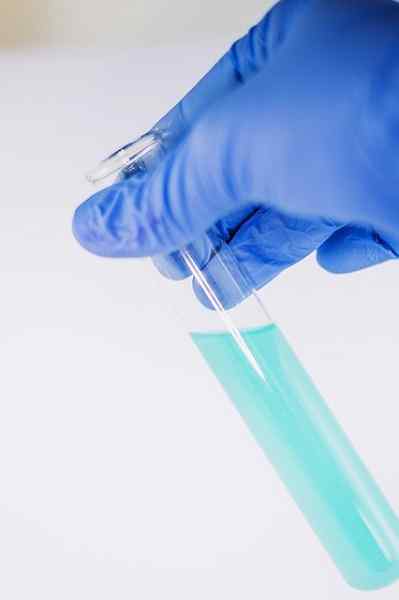 FECL3 Fenolien läsnä ollessa se antaa sinertävän vihreän värin. Kirjoittaja: Ewa Urban. Lähde: Pixabay.
FECL3 Fenolien läsnä ollessa se antaa sinertävän vihreän värin. Kirjoittaja: Ewa Urban. Lähde: Pixabay. Sitä käytetään myös testeissä tiettyjen vihanneksista uutettujen öljyjen antioksidanttivaikutuksen määrittämiseksi.
Toinen sen sovelluksista on, että se mahdollistaa muiden kemiallisten yhdisteiden valmistelun. Se voi toimia myös hapettavana, kloorauksena (tarjoa kloori) ja lauhduttimena (yhdistää kaksi tai useampia molekyylejä toistensa kanssa).
Se toimii myös orgaanisten kemian reaktioiden katalyyttinä tai kiihdyttiminä.
Useissa sovelluksissa
Ferrikloridia käytetään painetuissa elektronisissa piireissä. Niiden erilaisten hydratoitujen muotojen värillä se toimii pigmenttinä ja sitä käytetään nahkaparkitsissa.
 FECL3 Sitä käytetään nahkaparkituksessa. Kirjoittaja: Pexels. Lähde: Pixabay.
FECL3 Sitä käytetään nahkaparkituksessa. Kirjoittaja: Pexels. Lähde: Pixabay. Se on desinfiointiaine. Sitä käytetään ihosäirauksien hoitamiseen ja sitä käytetään myös valokuvauksessa.
Riskejä
FECL -jauhe3 Se on ärsyttävää silmille, nenästä ja suusta. Jos hengitys voi aiheuttaa yskää tai hengitysvaikeuksia. Se on syövyttävä yhdiste, joten pitkittynyt kosketus ihon kanssa ja silmien tai limakalvojen kanssa voi aiheuttaa punoitusta ja palovammoja.
Se ei ole syttyvä.
FECL3 Se on haitallista vesi- ja maa -organismeille. Jos vahingossa se hylätään ympäristölle, sen happamuus emäksisillä yhdisteillä on neutraloitava.
Viitteet
- TAI.S. Lääketieteen kansalliskirjasto. (2019). Ferrikloridi. PubChemistä toipunut.NCBI.Nlm.NIH.Hallitus.
- Kirk-Othmer (1994). Kemiallisen tekniikan tietosanakirja. Osa 19. Neljäs painos. John Wiley & Sons.
- Ullmannin teollisuuskemian tietosanakirja. (1990). Viides painos. Volume A22. Vch verlagsgellschaft mbh.
- Ngameni, b. et al. (2013). Flavonoidit ja siihen liittyvät yhdisteet Afrikan lääkekasveista. Flavonoidien karakterisointi kasviuutteissa. Ferrikloriditesti. Lääketieteellisessä tutkimuksessa Afrikassa. ScienEdirect.com.
- Agyare, c. et al. (2017). Petroselinum Crispum: Arvostelu. Antioksidanttiaktiivisuus. Afrikan lääkkeissä ja vihanneksissa. ScienEdirect.com.
- Stott, r. (2003). Loisten kohtalo ja käyttäytyminen jätevedenkäsittelyjärjestelmissä. Kemiallisesti avustettu sedimentaatio. Vesi- ja jäteveden mikrobiologiassa. ScienEdirect.com.
- Tasker, p.-Lla. et al. (2003). Koordinointikemian sovellukset. Cu: n poistoII Kloridiliuoksista. Koordinointikemian ymmärtämisessä. ScienEdirect.com.
- Puuvilla, f. Albert ja Wilkinson, Geoffrey. (1980). Edistynyt epäorgaaninen kemia. Neljäs painos. John Wiley & Sons.
- « +125 Lyhyt ja suositut sanat [merkityksellä]
- 95 sanontaa ja sanoi venezuelalaisia ja heidän merkityksensä »

