Elohopeakloridi (II) rakenne, ominaisuudet, hankkiminen, käyttö

- 3975
- 746
- Eddie Hackett
Hän Elohopeakloridi (II) Se on epäorgaaninen yhdiste, joka on muodostettu metalliolohopean (HG) atomilla ja kloorihalogeenin (CL) kahdella atomilla (CL). Elohopea on +2 hapetustilassa ja kloorissa -1.
Sen kemiallinen kaava on HGCL2. Se on hiukan haihtuva kiteinen kiinteä kiinteä lämpötila. Atomien ammattiliitot ovat kovalenttisia kuin ioninen.
 Elohopeakloridi (II). MRGREEN71/CC BY-SA (https: // creativecommons.Org/lisenssit/by-SA/3.0). Lähde: Wikimedia Commons.
Elohopeakloridi (II). MRGREEN71/CC BY-SA (https: // creativecommons.Org/lisenssit/by-SA/3.0). Lähde: Wikimedia Commons. Kun liukenee veteen, se ylläpitää molekyylirakennetta. Se on myös liukoinen useissa orgaanisissa liuottimissa. Valon valossa sillä on taipumus muodostaa metallinen elohopea.
Aikaisemmin sitä käytettiin antiseptisenä ja tiettyjen tartuntatautien hoitamiseksi sekä ihmisillä että eläimillä. Myös hyönteismyrkkynä tuholaisten, kuten muurahaisten ja termiittien hallitsemiseksi.
Kuitenkin, kun niiden korkea toksisuus on varmennettu, suurin osa näistä käytöistä hylättiin ja sitä käytetään tällä hetkellä vain kemiassa tai biokemiallisissa analyysilaboratorioissa.
Voi hyödyntää tietyissä olosuhteissa. Se on myrkyllinen yhdiste, se aiheuttaa haittaa ihmisille, eläimille ja kasveille. Sitä ei tule koskaan hylätä ympäristölle. Sitä epäillään myös syöpää.
[TOC]
Rakenne
Elohopeakloridi koostuu Hg: stä hapettumisessa II ja kloorissa Valencia -1: n kanssa. Tässä haluroissa atomien välisissä yhteyksissä on erittäin merkittävä kovalenttinen merkki.
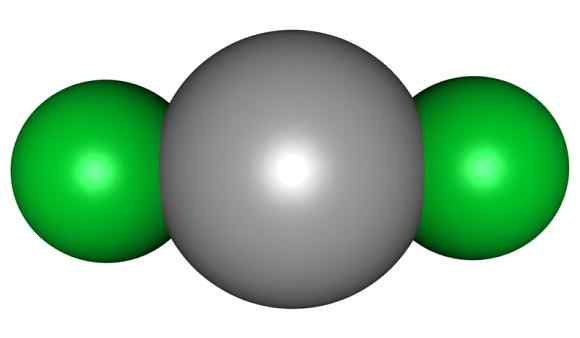 HGCL -molekyyli2. Harmaa = elohopea; Vihreä = kloori. Nuolenpäällikkö / julkinen alue. Lähde: Wikimedia Commons.
HGCL -molekyyli2. Harmaa = elohopea; Vihreä = kloori. Nuolenpäällikkö / julkinen alue. Lähde: Wikimedia Commons. Tämä tarkoittaa, että lasissa yhdiste ylläpitää molekyylirakennetta CL-HG-CL, missä HG-CL-etäisyys on samanlainen kuin kun se on kaasumaisessa tilassa, kun taas lasissa etäisyys muiden molekyylien klooriatomien kanssa on paljon vanhukset.
 HGCL -molekyylijärjestely2 Lasissa. Benjah-BMM27 / julkinen verkkotunnus. Lähde: Wikimedia Commons.
HGCL -molekyylijärjestely2 Lasissa. Benjah-BMM27 / julkinen verkkotunnus. Lähde: Wikimedia Commons. Kaasumaisessa tilassa se on selvästi molekyyli ja myös vesiliuoksessa.
Nimikkeistö
- Elohopeakloridi (II)
- Elohopeakloridi
- Elohopeabikloridi
- Diklooromercurio
Ominaisuudet
Fyysinen tila
Valkoinen kiteinen kiinteä, rombistikiteitä.
 Kiinteä elohopeakloridi. Leiem/CC BY-SA (https: // creativecommons.Org/lisenssit/by-SA/4.0). Lähde: Wikimedia Commons.
Kiinteä elohopeakloridi. Leiem/CC BY-SA (https: // creativecommons.Org/lisenssit/by-SA/4.0). Lähde: Wikimedia Commons. Molekyylipaino
271,5 g/mol
Sulamispiste
280 ºC
Sublimointipiste
300 ° C: ssa sublima, ts.
Tiheys
5,6 g/cm3
Liukoisuus
Pikku vesiliukoinen: 7,31 g/100 ml 25 ° C: ssa. Alkoholiliukoinen: 33 g/ 100 ml 25 ° C: ssa. Etyyliasetaatti. Pieni liukoinen eetterissä: 4 g/100 ml. Jotain liukenevaa bentseeniin.
Se voi palvella sinua: Helmholtz Free Energy: Yksiköt, miten se lasketaan, ratkaistu harjoituksetPHE
Liuoksen, joka on 0,2 moolia/L, pH on 3,2-4,7.
Kemialliset ominaisuudet
Vesipitoisessa liuoksessa HGCL -molekyylin muodossa on melkein yksinomaan (∼ 99%)2. Se kärsii kuitenkin jonkin verran hydrolyysiä:
HGCL2 + H2Tai ⇔ Hg (OH) Cl + H+ + Cl-
HGCL2 + 2 h2Tai ⇔ Hg (OH)2 + 2 h+ + 2 Cl-,
Siinä on merkitty liukoisuus orgaanisissa liuottimissa, missä se on dimeerien muodossa, ts. Kaksi sidottuja molekyylejä.
Orgaanisen aineen läsnä ollessa ja auringonvalon vaikutuksella se vähenee muodostaen elohopeakloridia (I) (HGCL) ja sitten metallista elohopeaa.
HGCL2 + Auringonvalo → Hgcl → Hg0 -
Natriumhydroksidiliuoksella (NaOH) tuottaa keltaisen esikatselun keltaisen sakan (HGO).
Se on yhteensopimaton tai reagoi muotojen, sulfiitien, fosfaattien, sulfidien, gelatiinin, albumiinin, alkalin, ammoniakin, kalsiumhydroksidin, bromidien, karbonaattien, raudan, kuparin, lyijyn, hopeasuolan ja joitain kasvimateriaalien kanssa.
Muut ominaisuudet
Muun muassa kovalenttisimpaan kuin ioniseen luonteeseen, se on hiukan haihtuva huoneenlämpötilassa ja se on huomattavasti haihtuneita 100 ° C: ssa.
Saada
Voit valmistaa hapettavia metallisia elohopeaa (HG0 -) kloorikaasulla (CL2-A. Kun lämmitetään ja saavutetaan yli 300 ° C2.
Hg + Cl2 + Lämpö → HGCL2
Se saadaan myös kuumentamalla elohopeasulfaatti (II) kuivua natriumkloridilla. HGCL -höyryt2 että subliman on kerätty ja tiivistetään kiteiseksi kiinteäksi.
HGSO4 + 2 NaCl → HgCl2 + Naa2Sw4
Elohopeaoksidin (II) välinen reaktio suolahapon kanssa stökiometrisissä määrissä tuottaa HGCL -kiteitä2 Kun väliaine jäähdytetään.
HGO + 2 HCL → HGCL2 + H2JOMPIKUMPI
Kiteet voidaan puhdistaa uudelleenkiteyttämällä ja sublimointiin.
Sovellukset
Kemiallisissa laboratorioissa
Sitä käytetään reagenssina erilaisissa kemiallisissa analyyseissä. Se mahdollistaa muiden elohopeayhdisteiden, kuten elohopeajodidin (II), elohopeaoksidin (II), elohopeakloridin (I), ammoniumin ja elohopeakloridin (II), valmistuksen (II).
Voi palvella sinua: Fluori: Historia, ominaisuudet, rakenne, hankkiminen, riskit, käytötPatologialaboratorioissa
Se on osa Zenkerin etikkaliuosta, jota käytetään luuytimen biopsioiden näytteiden tai näytteiden käsittelemiseen. Kudokset asetetaan nopeasti erinomaisilla histologisilla yksityiskohdilla, joita voidaan havaita mikroskoopilla.
 Joskus HGCL2 Sitä käytetään patologialaboratorioissa. Kirjoittaja: Ernesto Eslava. Lähde: Pixabay.
Joskus HGCL2 Sitä käytetään patologialaboratorioissa. Kirjoittaja: Ernesto Eslava. Lähde: Pixabay. Hylätyt käytöt
Keskiajalla ja XX: n alkuun saakka sitä käytettiin erilaisissa sovelluksissa, koska sen haitallista vaikutusta terveydelle ei tiedetä.
- Tiettyjen sairauksien hoidossa ajankohtainen antiseptinen ja desinfiointiaine.
 Aikaisemmin HGCL2 Sitä käytettiin syfilisen hoitamiseen. G. H. Kettu / julkinen alue. Lähde: Wikimedia Commons.
Aikaisemmin HGCL2 Sitä käytettiin syfilisen hoitamiseen. G. H. Kettu / julkinen alue. Lähde: Wikimedia Commons. - Eläinlääketieteessä kaustisena, desinfiointiaineena ja antiseptisenä aineena.
- Maataloudessa hän toimi sienitautien torjunta -aineena, kuten matojen, kuten hyönteismyrkky ja torakan torjunta, muurahaiset ja termiitit sekä desinfiointiaineena siementen ja sipulien suojelemiseksi.
- Puun säilyttämistä varten kemiallinen aine embalmin ja säästämiseksi anatomisia näytteitä.
- Katalyyttinä vinyylikloridin saamiseksi asetyleenistä.
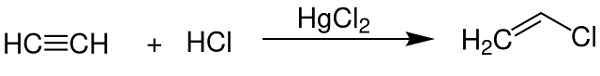 Elohopeakloridi (II) toimii katalysaattorina saadaksesi joitain kemiallisia yhdisteitä. Chem Sim 2001 / julkinen alue. Lähde: Wikimedia Commons.
Elohopeakloridi (II) toimii katalysaattorina saadaksesi joitain kemiallisia yhdisteitä. Chem Sim 2001 / julkinen alue. Lähde: Wikimedia Commons. - Alumiinielektrodissa.
- Raudan ja teräs.
- Valokuvausreagenssina.
- Kankaiden painatuksessa kanin ja risiini turkiksen mordina.
- Kuivattujen akkujen komponentti.
Riskejä
Terveydelle
Se on syövyttävä ja erittäin myrkyllinen yhdiste, jos se on nautittu, koska se voi aiheuttaa kuolemaa. Hyökkää maha -suolikanavaan ja munuaisjärjestelmään. Aiheuttaa vakavia palovammoja iholla ja silmillä.
Pitkäaikainen tai toistuva altistuminen tälle yhdisteelle aiheuttaa vaurioita sisäelimille. Kaikki elohopeamuodot ovat myrkyllisiä ja HGCL2 on yksi myrkyllisimmistä.
Epäillään, että se on syöpää.
Palovaara
Vaikka polttoaine ei voi räjähtää lämpöä levitettäessä. Kun se hajottaa myrkyllisiä ja elohopeamyrkyllisiä kaasuja.
HGCL -seokset2 Alkalimetallien, kuten natriumin tai kaliumin, kanssa ne ovat erittäin herkkiä iskuille ja voivat hyödyntää iskuja. Jos joudut kosketuksiin ammoniakin, sulfidien, oksaalihapon ja asetyleenin kanssa, voi myös räjähtää.
Voi palvella sinua: suolahappo (HCL)Vaikutukset ympäristöön
Se on erittäin myrkyllistä vesi- ja maa -organismeille, sen vaikutukset kestävät ajan myötä. Se voi esiintyä biologisesti koko ruokaketjussa, sekä kasveissa että eläimissä.
 Elohopeakloridia ei tule koskaan hylätä ympäristössä. Kirjoittaja: Naadjuuh. Lähde: Wikimedia Commons.
Elohopeakloridia ei tule koskaan hylätä ympäristössä. Kirjoittaja: Naadjuuh. Lähde: Wikimedia Commons. Se vaikuttaa hengityksen, fotosynteesiin ja muihin kasvien aineenvaihduntapolkuihin, jotka aiheuttavat niiden heikkenemistä. Sen asennusta ympäristöön (ei vettä, maaperää tai ilmakehää) ei pitäisi vaikuttaa).
Vaarallinen läsnäolo joissain luonnollisissa lääkkeissä
Myrkyllisyydestään huolimatta on luonnollisia lääkkeitä ja yrttejä, jotka sisältävät sitä, joten ihmiset tietämättä sitä ovat vaarallisesti alttiina tälle yhdisteelle.
Esimerkiksi perinteisessä kiinalaisessa lääketieteessä Calomel tai Qing Fen sisältää jonkin verran HGCL: tä2. Se on lääke, jota käytetään diureettisena, antiseptisenä, ihovoidena, laksatiivisena ja levitettäessä ulkoisesti hampaiden epämukavuutta lapsilla.
 Jotkut YK: n kontrolloidut luonnolliset lääkkeet voivat sisältää HGCL: tä2. Kirjoittaja: Silvija -olennot. Lähde: Pixabay.
Jotkut YK: n kontrolloidut luonnolliset lääkkeet voivat sisältää HGCL: tä2. Kirjoittaja: Silvija -olennot. Lähde: Pixabay. Viitteet
- TAI.S. Lääketieteen kansalliskirjasto. (2019). Elohopeakloridi. PubChemistä toipunut.NCBI.Nlm.NIH.Hallitus.
- S, s.C. (2010). Näytteenkäsittely. Zenkerin etikkakiinnitys (oranssi). Kirurgisen patologian käsikirjassa (kolmas painos). ScienEdirect.com.
- Clarkson, T.W -. (2001). Edustajat. Fysikaaliset ja kemialliset ominaisuudet. Peticid -toksikologian käsikirjassa (toinen painos). ScienEdirect.com.
- Fretham, s.J -.B -. et al. (2015). Elohopea ja neurodegeneraatio. Luonnollisia lääkkeitä ja yrttejä, jotka sisältävät HG: tä. Bioaktiivisissa ravitsemuksissa ja ravintolisissä neurogisissa ja aivosairauksissa. ScienEdirect.com.
- Ritari, s. et al. (2014). Vesikasvien jakautuminen ja runsaus - ihmisen vaikutukset. Kemialliset polutantit. Viitemodulaatiossa maajärjestelmissä ja ympäristötieteissä. ScienEdirect.com.
- Lyijy, d.R -. (Toimittaja) (2003). CRC: n kemian ja fysiikan käsikirja. 85th CRC -lehdistö.
- Puuvilla, f. Albert ja Wilkinson, Geoffrey. (1980). Edistynyt epäorgaaninen kemia. Neljäs painos. John Wiley & Sons.
- Ciavatta, l. ja grimaldi, m. (1968). Elohopean (II) kloridin hydrolyysi, HGCL2. Epäorgaanisen ja ydinkemian Journal, osa 30, numero 2, helmikuu 1968, sivut 563-581. ScienEdirect.com.
- Wikimedia -säätiö (2020). Elohopea (ii) kloridi. Haettu jstk.Wikipedia.org.
- « 21 meksikolainen tutkija ja heidän historiallinen panos
- Elohopea fulminoi rakenne, ominaisuudet, hankkiminen, käyttö »

