Kemiallinen yhdiste
- 4476
- 540
- Louis Moen
Selitämme, mitkä kemialliset yhdisteet koostuvat, tyypeistä, jotka ovat olemassa kemiallisten elementtien kanssa ja annamme useita esimerkkejä.
 Kemialliset yhdisteet ovat kaikki aineita, joilla on kahden erilaisen kemiallisen elementin atomit
Kemialliset yhdisteet ovat kaikki aineita, joilla on kahden erilaisen kemiallisen elementin atomit Mikä on kemiallinen yhdiste?
Eräs kemiallinen yhdiste Se on aine, jonka muodostuu kahden tai useamman atomin yhdistäminen eri kemiallisista elementeistä. Kemialliset yhdisteet pysyvät yhtenäisinä kemiallisten sidosten ansiosta, jotka liittyvät kytkettyjen atomien elektroneihin; Eli kemiallisessa yhdisteessä atomien (uloimmin) elektronit puuttuvat linkkien muodostumiseen.
Kemiallisten yhdisteiden (kemiallisia elementtejä) komponentteja ei voida erottaa toisistaan fysikaalisilla menetelmillä, kuten: tislaus, sentrifugointi, suodatus jne., vaatii kemiallisia menetelmiä sen saavuttamiseksi.
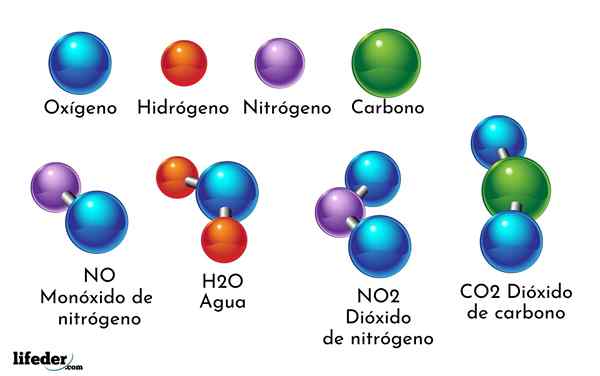
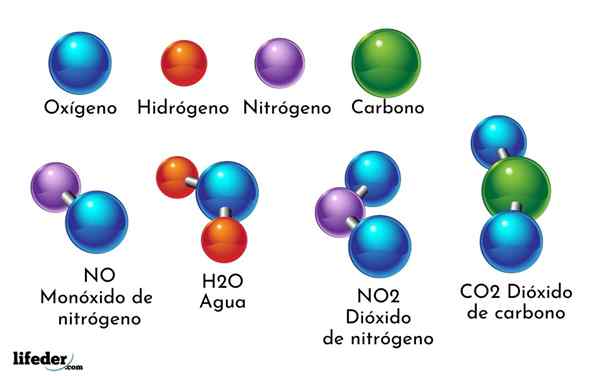
Esimerkki kemiallisesta yhdisteestä on vesi. Se muodostuu vain kahdesta kahdesta kemiallisesta elementin atomista: happi ja vety, joilla on kemiallinen kaava H2JOMPIKUMPI. Siksi kaksi h sitoutuu yhdellä tai muodossa h2JOMPIKUMPI.
Kemiallinen elementti, toisin kuin kemialliset yhdisteet, on yksinkertaisin ja perusteellisin tapa, joka muodostaa aineen. Se esitetään ainutlaatuisena atomityypinä, jota ei voida jakaa yksinkertaisempiin aineisiin kemiallisilla reaktioilla.
Kemiallisten yhdisteiden tyypit
Kemialliset yhdisteet voidaan luokitella pääasiassa kahden kriteerin seurauksena:
- Sidoksen tyypin mukaan, joka yhdistää kemiallisessa yhdisteessä olevat kemialliset elementit.
- Kemiallisen yhdisteen koostumuksen ja rakenteen mukaan.
Linkin tyypin mukaan
Linkkityypistä riippuen kemialliset yhdisteet voivat olla:
- Molekyylit. Ne ovat kemiallisia yhdisteitä, jotka muodostavat kaksi tai useampia erilaisia kemiallisia elementtejä, jotka yhdistetään kovalenttisella sidoksella. Tälle linkille on ominaista yhden tai useamman ulkoisen elektronin tai Valencian parin jakaminen kahden atomin väliin.
- Ionit. Sähköisesti ladattuja kemiallisia yhdisteitä kutsutaan ionikemiallisiksi yhdisteiksi, ja niiden ionit yhdistyvät ioniyhteys. Tämä sidos tapahtuu liittyessään metallityypin kemialliseen elementtiin ei -metallisella kemiallisella elementillä.
- Metallien väliset yhdisteet. Se on eräänlainen metalliseos, joka muodostaa kiinteän materiaalin, joka on kahden tai useamman metallikemiallisen elementin välillä niiden pitämiseksi yhdessä.
- Koordinaatio. Ne muodostetaan keskusmetallielementti, jota kutsutaan koordinointikeskukseksi, ja ne ympäröivät joukkoa yhtenäisiä molekyylejä tai ioneja, jotka tunnetaan ligandina. Esimerkiksi hemoglobiini on proteiini, jota löytyy punasoluista ja joka kuljettaa happea veressä. Hemoglobiinilla on koordinointiyhdiste nimeltä Grupo Hemo. Hemon keskellä on rautatomi, joka puuttuu hapen kuljetukseen hemoglobiinin kautta.
Koostumuksen ja rakenteen mukaan
Tämän kriteerin mukaan kemialliset yhdisteet luokitellaan orgaaniseksi ja epäorgaaniseksi.
- Orgaaniset yhdisteet. Ne ovat yhdisteitä, joiden tärkein kemiallinen elementti on hiili, joka yleensä muodostaa yhteydet saman hiilen ja vedyn atomiin. Niitä on kuitenkin myös läsnä, vaikkakin vähemmässä määrin happi, typpi, rikki, boori, fosfori jne. Orgaaniset yhdisteet voivat olla:
- Alifaattinen. Alifaattisten yhdisteiden molekyyleillä voi olla lineaarisia tai syklisiä muotoja, toisin sanoen suljettuina muodoissa, kuten kolmioissa, neliöissä, viisikulmioissa jne. Heillä voi olla kolmen tyyppisiä hiilisidoksia: yksinkertaiset (c-c), kaksinkertaiset (c = c) tai kolminkertaiset (c≡c).
- Aromaattinen. Ne ovat syklisiä yhdisteitä, joilla on vuorotellen yksinkertaisia hiili-hiili-sidoksia ja kaksoishiili-hiilisidoksia.
- Heterosyklinen. Ne ovat yhdisteitä, joilla on syklinen rakenne, jotka voivat esitellä hiiliatomin korvaamisen toisella kemiallisella elementillä (O, S, N jne.-A.
- Organometalli. Ne ovat orgaanisia yhdisteitä, jotka voivat esiintyä koostumuksen metallielementeissä.
- Polymeerit. Ne ovat suuria molekyylejä (makromolekyylejä), jotka muodostavat pienet ja identtiset yksiköt, jotka toistetaan koko polymeerissä ja joita kutsutaan monomeerioiksi.
- Epäorgaaniset yhdisteet. Epäorgaanisilla yhdisteillä, toisin kuin orgaaniset yhdisteet, ei ole hiiltä keskuskemiallisena elementtinä, vaan puuttuvat pikemmin. Epäorgaaniset yhdisteet voivat olla:
- Perusoksidit. Ne muodostetaan metallikemiallisen elementin, kuten natriumin, kalsiumin, raudan, kuparin jne. Reaktiolla., Happea. Esimerkiksi natriumoksidi (NAO) on emäksinen oksidi. Niitä kutsutaan perusoksideiksi, koska ne aiheuttavat emäksiä tai hydroksideja.
- Happosioksidit. Ne ovat peräisin ei -metallisesta kemiallisesta elementin, kuten kloorista, fluorista, rikki, bromista jne. Reaktiosta., Happea. Esimerkiksi bromioksidi (BR2JOMPIKUMPI5) Se on happioksidi. Niitä kutsutaan happioksideiksi, koska ne aiheuttavat happoja.
- Hydrorit. He esiintyvät kemiallisessa koostumuksessaan vedyn läsnäolo. On kahta tyyppiä: metalliset hydros- ja ei -metalliset hydrorit.
- Metalli. Ne muodostuvat vedyn reaktiolla hapetustilassa -1, metallilla. Nämä kemialliset yhdisteet ovat ainoat, joissa vetyä on hapetustilassa -1. Esimerkiksi CAH2 Se on kalsiumhydridi.
- Ei metallinen. Ne muodostuvat vedyn reaktiolla, hapetustilan + 1 kanssa, ei -metallisella elementillä sen alhaisemmalla hapettumistilalla. Kloorihydridi (HCL) on kaasu, joka kun suolahappo liuotetaan veteen.
- Hapot. Ne ovat epäorgaanisia kemiallisia yhdisteitä, vaikka on orgaanisia happoja, joiden pH on alle 7 ja kääntyvät punaisen punaisen paperin väriin punaiseksi. Ne voidaan luokitella hydrycycideiksi ja oksasideiksi.
- Hydraatio. Ne ovat peräisin vedyn reaktiosta ei -metallilla muodostaakseen hydridin, joka liukenee veteen, syntyy happoa; Esimerkiksi iarhydric -happo (HI).
- Oksikasidit. Se on peräisin ei -metallisesta kemiallisen elementin oksidin reaktiosta vedellä. Esimerkiksi rikkioksidireaktio (niin3) Vesi tuottaa rikkihappoa (H2Sw4-A.
- Menet ulos. Ne ovat kemiallisia yhdisteitä, jotka ovat peräisin hapon ja emäksisten yhdisteiden vuorovaikutuksesta. Sen koostumuksessa voi olla yhtä monta metallielementtiä kuin ei -metallista. Suolat luokitellaan seuraavasti:
- Neutraalit suolat. Ne ovat peräisin hapon ja emäksen välillä neutraloitumisreaktiosta suolan ja veden muodostumisen kanssa. Esimerkiksi natriumhydroksidireaktio (NaOH) suolahapon (HCL) kanssa tuottaa natriumkloridia (NaCl), suolaa ja vettä. Niitä kutsutaan neutraaliksi, koska ne eivät tuota pH: n variaatiota.
- Happasuolat. Ne muodostetaan metallihydroksidin reaktiolla Valencia +1: n kanssa, hapolla, jolla on useita vetyjä. Litiumhydroksidin (LIOH) reaktio hiilihapolla (H2Yhteistyö3), tuottaa vain yhden vedyn korvaamisen litiumilla, joka aiheuttaa litiumin bikarbonaatin (LIHCO3), Happasuola ja vesi.
- Perussuolat. Niitä tuotetaan emäksen reaktiolla, jolla on useampi kuin yksi ryhmä OH, esimerkiksi hydresahapon kanssa, suolahapon kanssa. Reagoiessasi happoa kalsiumhydroksidin kanssa, CA (OH)2, Klooriatomi korvaa hydroksyyliryhmän (OH). Tämä tuottaa kalsiumhydroksikloridia (cuckloh), emäksistä suolaa ja vettä.
Erot kemiallisten yhdisteiden ja kemiallisten elementtien välillä
 Kemialliset elementit ja kemialliset yhdisteet. Kemialliset yhdisteet muodostavat yllä olevat elementit
Kemialliset elementit ja kemialliset yhdisteet. Kemialliset yhdisteet muodostavat yllä olevat elementit Jokainen kemiallinen elementti vastaa tiettyä atomia ja vain tällaista atomia; Eli kemiallisella elementillä ei ole erityyppisiä atomeja. Atomi on aineen alkuainepartikkeli, jota ei ole jaettu fysikaalisilla tai kemiallisilla menetelmillä.
Kemiallisen elementin atomi voidaan yhdistää muiden kemiallisten elementtien atomien kanssa kemiallisten yhdisteiden muodostamiseksi, jotka voidaan erottaa niiden komponenteista (kemialliset elementit) kemiallisilla menetelmillä.
Kemialliset elementit ja kemialliset yhdisteet, joissa on palapeli.
Palapelipalat voivat liittyä muodostamaan erilaisia lukuja. Muodostuneet kuviot voitiin rinnastaa kemiallisilla yhdisteillä. Kun aktiviteetti on valmis, palapelin luvut voidaan erottaa sen muodostavista kappaleista.
Esimerkkejä kemiallisista yhdisteistä
Alla näet sarjan esimerkkejä päivittäisistä kemiallisista yhdisteistä:
- HCL: suolahappo
- H2S: Sulfhydric -happo
- HF: Fluorahappo
- H2Sw4: Rikkihappo
- Hclo4: Perkloorihappo
- H3Poikki4: Fosforihappo
- H2Yhteistyö3: Hiilihappo
- Hno3: Typpihappo
- NaOH: Natriumhydroksidi
- CA (OH)2: Kalsiumhydroksidi
- Usko (Voi)2: Rautahydroksidi
- Usko (Voi)3: Rautahydroksidi
- NAH: Natriumhydridi
- Cu2O: Kuproksinen oksidi
- CuO: kuplioksidi
- Usko2JOMPIKUMPI3: Rautaoksidi
- Cl2JOMPIKUMPI7: Perkloorioksidi
- Br2O: Hipobrominen oksidi
- Yllyttää2JOMPIKUMPI3: Hypodoosioksidi
- NaCl: Natriumkloridi
- FECL3: Ferrikloridi
- HCO3: Natriumbikarbonaatti
- CH3Polku: Natriumasetaatti
- Naa2Sw4: Natriumsulfaatti
- Feso4: Rautasulfidi
- H2O: Vesi
- Yhteistyö2: Hiilidioksidi
- C6H12JOMPIKUMPI6: Glukoosi
- C12H22JOMPIKUMPIyksitoista: Sakkaroosi
Muut kiinnostavat aiheet
Kemialliset reaktiot
Kemia jokapäiväisessä elämässä: Esimerkkejä
Orgaaniset yhdisteet
Epäorgaaniset yhdisteet
Kemiallinen sidos
Puhtaat aineet
Viitteet
- Whitten, Davis, Peck & Stanley. (2008). Kemia. (8. ed.-A. Cengage -oppiminen.
- Wikipedia. (2021). Kemiallinen yhdiste. Haettu: vuonna.Wikipedia.org
- Helmestine, Anne Marie, PH.D -d. (27. elokuuta 2020). Yhdistelmämääritelmä kemiassa. Toipunut: Admingco.com
- Toppr. (S.F.-A. Mikä on kemian yhdiste? Kemiallisen yhdisteen tyypit. Toipunut: Toppr.com

