Dikloorimetaanirakenne, ominaisuudet, käyttö, toksisuus

- 4973
- 485
- Gustavo Runte DVM
Hän dikloorimetaani, Tunnetaan myös nimellä metyleenikloridi, se on orgaaninen yhdiste, jonka kemiallinen kaava on CH2Cl2. Erityisesti se on metaanikaasusta johdettu alkyylihalogenidi. Toisin kuin metaani, tämä yhdiste on väritön ja polaarinen neste.
Sen syntetisoitiin alun perin vuonna 1839 ranskalainen kemisti ja fyysikko Henri Victor Regnault (1810-1878), joka onnistui eristämään hänet kloorin ja klorometaanin seoksesta, joka altistettiin auringonvalolle.
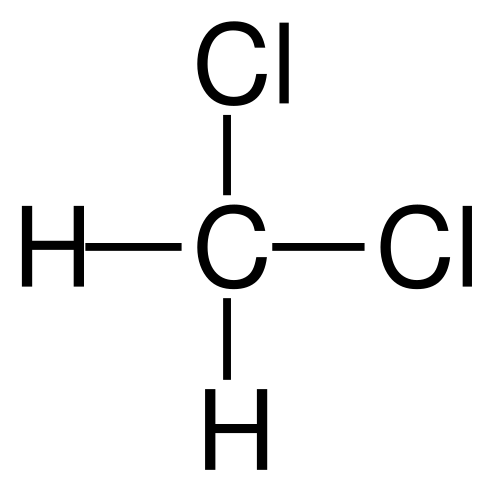 Dikloorimetaanin rakennekaava. Lähde: Jü [julkinen verkkotunnus]
Dikloorimetaanin rakennekaava. Lähde: Jü [julkinen verkkotunnus] Dikloorimetaania tapahtuu teollisesti käsittelemällä metaania tai klorometaania kloorikaasulla korkeassa lämpötilassa (400-500 ºC). Yhdessä dikloorimetaanin kanssa niitä esiintyy kloroformi- ja hiilitetrakloridiprosessissa, jotka on erotettu tislaamalla.
Dikloorimetaania käytetään liuottimena, joka mahdollistaa muovimateriaalien hitsauksen ja metallien rasvaamiseksi. Sitä käytetään myös kahvi- ja teetä kofeinissa.
Dikloorimetaani on myrkyllinen yhdiste, joka voi tuottaa sieraimien ja kurkun ärsytyksenä. Maksavaurioita on ilmoitettu altistuneissa työntekijöissä dikloorimetaanin korkeille pitoisuuksille. Lisäksi hän on mutageeninen aine, jonka epäillään olevan syöpää.
[TOC]
Rakenne
 Dikloorimetaanin molekyylirakenne. Lähde: Gabriel Bolívar Molviewin kautta.
Dikloorimetaanin molekyylirakenne. Lähde: Gabriel Bolívar Molviewin kautta. Ensimmäisessä kuvassa esitettiin CH: n rakennekaava2Cl2, jossa heidän kovalenttiset sidokset C-H ja C-C-CL erottuvat. Ylös ja sen rakenne edustaa malli palloista ja palkista. Huomaa ensi silmäyksellä, että C-H-sidokset (valkoiset pallot) ovat lyhyitä, kun taas C-C-C-C-Cl (vihreät pallot) sidokset ovat pitkät.
Cho -geometria2Cl2 Se on tetraedrinen; mutta vääristynyt suurimpien klooriatomien takia. Tetrahedron toinen pää määritellään kahdella klooriatomilla, enemmän elektronegatiivisella kuin vety ja hiili. Siksi CH: n molekyylissä2Cl2 Perustetaan pysyvä dipolimomentti (1.6d).
Voi palvella sinua: neutralointireaktioTämän avulla dikloorimetaanimolekyylit voivat olla vuorovaikutuksessa toistensa kanssa dipoli-dipolovoimien kautta. Samoin nämä molekyylien väliset vuorovaikutukset ovat vastuussa siitä, että tämä yhdiste on olemassa nesteinä pienestä molekyylimassastaan huolimatta; Neste, joka on kuitenkin melko haihtuva.
Ominaisuudet
Ulkomuoto
Väritön neste.
Moolimassa
84,93 g/mol.
Haju
Makea, samanlainen kuin kloroformi.
Hajukynnys
205 - 307 ppm.
Tiheys
1 3266 g/cm3 (20 ºC).
Sulamispiste
- 97,6 ºC.
Kiehumispiste
39,6 ºC.
Vesiliukoisuus
25,6 g/l 15 ºC: lla ja 5,2 g/l 6 60 ºC.
Dikloorimetaani on tuskin liukoinen veteen. Kun taas molemmat molekyylit, CHO2Cl2 ja h2Tai ne ovat polaarisia, heidän vuorovaikutuksensa ovat mahdollisesti tehottomia kloorin ja happiatomien välisen torjumisen vuoksi.
Liukoisuus muihin liuottimiin
Sekoittuu etyyliasetaatin, alkoholin, heksaanin, bentseenin, hiilitetrakloridin, dietyl -eetterin, kloroformin ja dimetyylimuodon kanssa.
Oktanoli/vesijakokerroin
Loki p = 1,19.
Höyrynpaine
57,3 kPa (25 ºC). Tämä paine vastaa noin 5,66 atm, mikä heijastaa korkeaa höyrynpainetta.
Höyrytiheys
2,93 ilmasuhteessa 1.
Taitekerroin (πD)
1 4244 (20 ºC).
Goo
0,413 CP (25 ºC).
sytytyspiste
Dikloorimetaani ei ole syttyvä, mutta sekoitettuna ilmaan se muodostaa syttyviä höyryjä yli 100 ºC.
Itsensuuntainen lämpötila
556 ºC.
Vakaus
Se on vakaa ympäristön lämpötilassa kosteuden puuttuessa, sillä sillä on suhteellinen stabiilisuus verrattuna sen sukupolveen: hiilitetrakloridikloroformi ja tetrakloridi.
Sillä on taipumus hibboloida korkeissa lämpötiloissa (300-450 ºC), kun niiden höyryt ovat kosketuksissa teräs- ja metallikloridien kanssa.
Hajoaminen
Se voidaan hajottaa kosketukseen kuumien pintojen tai liekin kanssa, joka säteilee myrkyllisiä ja ärsyttäviä höyryjä fosgen- ja vetykloridin höyryihin.
Voi palvella sinua: differentiaalielektroniKorroosio
Dikloorimetaani hyökkää joitain muoveja, kuppeja ja pinnoitteita.
Höyrystyslämpö
28,82 kJ/mol A 25 ºC.
Pintajännitys
28.20 dynas/cm 25 ºC: lla.
Reaktiivisuus
Dikloorimetaani reagoi voimakkaasti aktiivisten metallien, kuten kaliumin, natriumin ja litiumin, kanssa. Reagoi vahvojen emäksen kanssa, esimerkiksi kalium boutheksidi. Se on yhteensopimaton kaustisten aineiden, hapettimien ja kemiallisesti aktiivisten metallien kanssa.
Lisäksi se reagoi nestemäisen hapen kanssa natrium- ja kaliumseoksissa ja typpeteroksidissa. Kosketuksessa veteen voit käyttää ruostumattomia teräksiä, nikkeliä, kuparia ja rautaa.
Sovellukset
Suurin osa dikloorimetaanin käytöstä ja sovelluksista perustuu sen ominaisuuksiin liuottimena. Tämän ominaisuuden vuoksi dikloorimetaania käytetään elintarvikkeissa, liikenteessä, lääketieteen tuotantoteollisuudessa jne.
Ruuan prosessointi
Dikloorimetaania käytetään kofeiinitussa kahvijyvissä ja teelehdessä. Sitä käytetään myös oluen, juomien ja muiden ruokalippujen sekä mausteen jalostuksen humalan poistoon.
Lääketeollisuus
Dikloorimetaania käytetään kefalosporiinin ja ampisilliinin valmistukseen antibioottien, steroidien ja vitamiinien valmistuksen lisäksi.
Valokuvaus
Sitä käytetään myös liuottimena selluloosatriaketaatin (CTA) tuotannossa, jota käytetään turvallisuuselokuvien luomisessa.
Elektroninen teollisuus
Se on ihanteellinen yhdiste tulostettujen piirilevyjen tuotantoon käyttämällä alumiinipintaa ennen levyn fotoretin lisäämistä.
Maalit
Dikloorimetaani on liuotin, joka löytyy lakoista ja maalierottimista, joita käytetään erityyppisten pintojen maalauksien eliminoimiseksi tai pinnoitteesta.
Kuljetus
Se palvelee rautatielaitteissa esiintyviä metalliosia ja pintoja sekä lentokonekomponentteja.
Voi palvella sinua: tislattua vettäMuut käyttötarkoitukset
Sitä käytetään ruiskutuspisteenä (aerosolit) ja polyuretaanivaahdon laajennusaineena. Sitä käytetään myös nesteenä tietyntyyppisissä jouluvaloissa.
Myrkyllisyys
Akuuttit vaikutukset
Dikloorimetaanin hengitys voi aiheuttaa ylemmän hengitysteiden ärsytystä, yskää, hengityksen tai ilman puutetta.
Se voi tuottaa ihon punoitusta, ja jos yhdiste pysyy pitkään siihen, aiheuttaa kemiallisia palovammoja. Kontaktissa silmiin dikloorimetaani tuottaa vakavan ärsytyksen, joka voi ulottua palamaan.
Lisäksi se toimii neurotoksiinina, joka tuottaa visuaalisia, kuulo- ja psykomotorisia muutoksia; Mutta nämä vaikutukset ovat palautuvia dikloorimetaanin hengittämisen lopettamiseksi.
Krooniset vaikutukset
Dikloorimetaani voi vaikuttaa keskushermostoon ja aiheuttaa päänsärkyä, henkistä sekaannusta, pahoinvointia, oksentelua ja muistin menetystä.
Eläimissä se tuottaa haitallisia vaikutuksia maksaan, munuaiseen, keskushermostoon ja sydän- ja verisuonijärjestelmään.
Heti kun karsinogeneesi ei ole ilmoittanut dikloorimetaanille altistuneiden työntekijöiden syöpäkuolemien merkittävää kasvua. Eläintutkimukset ovat kuitenkin osoittaneet lisääntyneen dikloorimetaanista maksasyövän ja keuhkojen esiintyvyyden sekä maitorauhasten hyvänlaatuisten kasvaimien suhteen.
Viitteet
- Morrison, r. T. ja Boyd, R, N. (1987). Orgaaninen kemia. 5ta Painos. Toimituksellinen Addison-Wesley Inter-American.
- Carey f. (2008). Orgaaninen kemia. (Kuudes painos). MC Graw Hill.
- Graham Solomons t.W -., Craig B. Freedle. (2011). Orgaaninen kemia. (10th Painos.-A. Wiley Plus.
- Kansallinen bioteknologiatietojen keskus. (2020). Dikloorimetaani. Pubchem -tietokanta., CID = 6344. Toipunut: Pubchem.NCBI.Nlm.NIH.Hallitus
- Wikipedia. (2020). Dikloorimetaani. Haettu: vuonna.Wikipedia.org
- Brumero. (14. heinäkuuta 2018). Dikloorimetaani. Toipunut: Brumero.com
- MSDS Online. (2019). Dikloorimetaani (metyleenikloridi) vaarat ja turvallisuustiedot. Haettu: MSDSONLINE.com
- EPA. (2000). Metyleenikloridi (dikloorimetaani). [PDF]. Toipunut: EPA.Hallitus
- « Tuhkamenetelmien ja esimerkkien määrittäminen
- Etelä -Korean kulttuurin perinteitä, tapoja, gastronomiaa, uskontoa »

