Henderson-Haselbalch-yhtälön selitys, esimerkit, liikunta
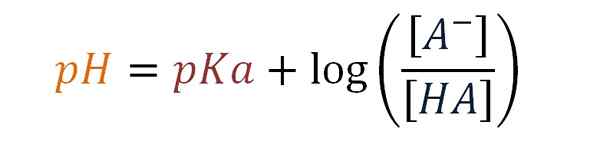
- 4209
- 1354
- Arthur Terry II
Se Henderson-Haselbalch-yhtälö Se on matemaattinen ekspressio, joka mahdollistaa iskunvaimennuksen tai vaimennusliuoksen pH: n laskemisen. Se perustuu hapon PKA: hon ja vaimennusliuoksessa läsnä olevaan konjugaatin tai suolan ja happopitoisuuksien väliseen suhteeseen.
Yhtälön on alun perin kehittänyt Lawrence Joseph Henderson (1878-1942) vuonna 1907. Tämä kemisti perusti yhtälön komponentit, jotka perustuvat hiilihappoon puskurina tai puskuriliuoksena.
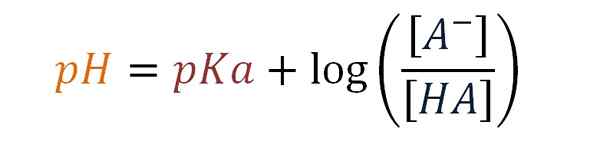 Henderson-Haselbalch-yhtälö. Lähde: Gabriel Bolívar.
Henderson-Haselbalch-yhtälö. Lähde: Gabriel Bolívar. Myöhemmin Karl Albert Hasselbalch (1874-1962) esittelee vuonna 1917 logaritmien käyttöä Hendersonin yhtälön täydentämiseksi. Tanskalainen kemisti tutki verreaktioita happea ja vaikutusta hänen pH: iin.
Puskuriliuos pystyy minimoimaan pH -muutokset, jotka kärsivät liuoksesta lisäämällä vahva happo- tai emästilavuus. Se muodostuu heikko happo ja sen vahva konjugoitu emäs, joka on nopeasti dissosioitunut.
[TOC]
Selitys
Matemaattinen kehitys
Vesipitoisessa liuoksessa oleva heikko happo dissosioituu massatoimenpiteen lain mukaan seuraavan järjestelmän mukaan:
Ha +h2Tai ⇌ h+ + -Lla-
Ha on heikko happo ja- Konjugoitu pohja.
Tämä reaktio on palautuva ja siinä on tasapainovakio (KA):
Ka = [h+] · [-] / [Ha]
Logaritmien ottaminen:
log ka = log [h+] +Loki [a-] -log [ha]
Jos jokainen yhtälön termi kerrotaan (-1), se ilmaistaan seuraavalla tavalla:
- log ka = - loki [h+] -log [a] +loki [ha]
- Log KA määritellään PKA: ksi ja - log [h+] on määritelty pH: ksi. Osautumisen tekemisen jälkeen matemaattinen ilmaisu vähenee:
pka = ph -log [a-] +Loki [ha]
PH: n ja uudelleenryhmittelytermien tyhjentäminen, yhtälö ilmaistaan seuraavalla tavalla:
Voi palvella sinua: kolminkertainen kovalentt linkkiph = pka +log [a-] / [Ha]
Tämä on Henderson-Haselbalch-yhtälö heikon hapon muodostamalle iskunvaimentimelle.
Yhtälö heikkolle pohjalle
Samoin heikko emäs voi muodostaa puskuriliuoksen ja Henderson-Haselbalch-yhtälö on seuraava:
Poh = pkb +log [hb] / [b--
Suurin osa vaimennusliuoksista on kuitenkin peräisin, mukaan lukien fysiologinen merkitys, heikon hapon dissosiaatiosta. Siksi Henderson-Haselbalch-yhtälön eniten käytetty ilmaisu on:
ph = pka +log [a-] / [Ha]
Kuinka puskuriliuos toimii?
Iskunvaimentimen vaikutus
Henderson-Haselbalch-yhtälö osoittaa, että tämä liuos muodostuu heikko happo ja voimakas konjugoitu emäs, joka ilmenee suolana. Tämä koostumus antaa vaimennusliuoksen pysyä stabiililla pH: lla, vaikka vahvoja happoja tai emäksiä lisätään.
Lisäämällä vahva happo iskunvaimennukseen, se reagoi konjugoituun emäkseen suolan ja veden muodostamiseksi. Tämä neutraloi happoa ja sallii pH: n vaihtelun olevan minimaalinen.
Nyt, jos iskunvaimentimeen lisätään vahva emäs, se reagoi heikon hapon ja veden muodon ja suolan kanssa, neutraloimalla lisätyn emäksen vaikutuksen pH: hon. Siksi pH: n vaihtelu on minimaalinen.
Puskuriliuoksen pH riippuu konjugaattipohjapitoisuuksien ja heikon hapon suhteesta, ei näiden komponenttien pitoisuuksien absoluuttisesta arvosta. Vaimennusliuos vedellä voidaan laimentaa ja pH ei käytännössä vaihtele.
Iskunvaimennin kapasiteetti
Vaimennuskyky riippuu myös heikon hapon PKA: sta, samoin kuin heikon hapon ja konjugaattipohjan pitoisuuksista. Mitä lähempänä happoa PKA on vaimennusliuoksen pH, sitä suurempi sen vaimennuskyky.
Voi palvella sinua: Le Châtelier -periaateLisäksi mitä suurempi puskuriliuoksen komponenttien pitoisuus on, sitä suurempi sen vaimennuskyky on.
Henderson -yhtälöt esimerkkejä
Asetaattipuskuri
ph = pka +loki [CHO3Kujertaa-] / [CHO3Cooh]
PKA = 4,75
Hiilihappojen lämpötilan
ph = pka +log [HCO3-] / [H2Yhteistyö3-
PKA = 6,11
Globaali prosessi, joka johtaa bikarbonaatti -ionin muodostumiseen elävässä organismissa, on kuitenkin seuraava:
Yhteistyö2 + H2Tai ⇌ HCO3- + H+
Olla yhteistyö2 Kaasu, sen pitoisuus liuoksessa ilmaistaan sen osittaisen paineen mukaan.
ph = pka +log [HCO3-] / α · PCO2
α = 0,03 (mmol/l)/mmhg
PCO2 on Co: n osittainen paine2
Ja sitten yhtälö olisi kuten:
ph = pka +log [HCO3-] / 0,03 · PCO2
Laktaatin iskunvaimennin
pH = pka +log [laktaatti -ioni] / [maitohappo]
PKA = 3,86
Fosfaatti -iskunvaimennin
pH = pka +log [dibasinen fosfaatti] / [monobasinen fosfaatti]]
ph = pka +log [HPO42-] / [H2Poikki4--
PKA = 6,8
Oksihemoglobiini
ph = pka +log [HBO2-] / [HHBO2-
PKA = 6,62
Desoksihemoglobiini
ph = pka +log [Hb-] / Hbh
PKA = 8,18
Ratkaisut
Harjoitus 1
Fosfaatti -iskunvaimennin on tärkeä kehon pH: n säätelyssä, koska sen PKA (6.8) on lähellä kehon pH: ta (7,4). Mikä on suhteen arvo [na2HPO42-] / [Ei2Poikki4-] Henderson-Haselbalch-yhtälöstä arvolle pH = 7,35 ja PKA = 6,8?
Nahin dissosiaatioreaktio2Poikki4- On:
Ei2Poikki4- (happo) ⇌ Nahpo42- (Pohja) +h+
ph = pka +log [na2HPO42-] / [Ei2Poikki4--
Meillä on: puhdistamalla fosfaatin vaimennusliuoksen [konjugoitu / happo] -suhde: meillä on:
7,35 - 6,8 = loki [na2HPO42-] / [Ei2Poikki4--
0,535 = log [na2HPO42-] / [Ei2Poikki4--
100,535 = 10Log [Na2HPO4] / [NAH2PO4]
Se voi palvella sinua: difenyyliamiini3,43 = [Na2HPO42-] / [Ei2Poikki4--
Harjoitus 2
Asetaattipuskuriliuoksella on 0,0135 M etikkahappopitoisuus ja 0,0260 M natriumasetaattipitoisuus. Laske iskunvaimentimen liuoksen pH, tietäen, että asetaatti -iskunvaimentimen PKA on 4,75.
Etikkahappojen dissosiaatiotasapaino on:
CH3Cooh ⇌ ch3Kujertaa- + H+
ph = pka +loki [CHO3Kujertaa-] / [CHO3Cooh]
Korvataan arvot:
[CH3Kujertaa-] / [CHO3COOH] = 0,0260 m / 0,0135 m
[CH3Kujertaa-] / [CHO3Cooh] = 1 884
Log 1,884 = 0,275
pH = 4,75 +0,275
pH = 5,025
Harjoitus 3
Asetaatti -iskunvaimennin sisältää 0,1 M etikkahappoa ja 0,1 M natriumasetaattia. Laske vaimennusliuoksen pH, kun olet lisännyt 5 ml 0,05 m 10 ml: n suolahappoa.
Ensimmäinen vaihe on laskea HCL: n lopullinen konsentraatio sekoittuessa puskuriliuoksen kanssa:
Vi · ci = vf · vrt
CF = VI · (CI / VF)
= 5 ml · (0,05 m / 15 ml)
= 0,017 m
Suolahappo reagoi natriumasetaatin kanssa etikkahapon muodostamiseksi. Siksi natriumasetaattipitoisuus vähenee 0,017 M ja etikkahappopitoisuus kasvaa samalla määrällä:
pH = pka +log (0,1 m - 0,017 m) /(0,1 m +0,017 m)
pH = pka +log 0,083 / 0,017
= 4,75 -0,149
= 4 601
Viitteet
- Whitten, Davis, Peck & Stanley. (2008). Kemia. (8. ed.-A. Cengage -oppiminen.
- Jimenez Vargas ja J. Mª MacArlla. (1984). Fysiologinen fysikaalis -kemiallinen. 6. painos. Amerikanvälinen toimitus.
- Wikipedia. (2020). Henderson-Hasselbalch-yhtälö. Haettu: vuonna.Wikipedia.org
- Gurinder Khaira ja Alexander Kot. (5. kesäkuuta 2019). Henderson-Hasselbalch-likiarvo. Kemian librettexts. Palautettu: Chem.Librettexts.org
- Helmestine, Anne Marie, PH.D -d. (29. tammikuuta 2020). Henderson Hasselbalch -yhtälön määritelmä. Toipunut: Admingco.com
- Enyclopaedia Britannica -toimittajat. (6. helmikuuta 2020). Lawrence Joseph Henderson. Encyclopædia britannica. Toipunut: Britannica.com
- « Esipuheominaisuudet, toiminnot, esimerkit ja osat
- Säätiön refraktometria, tulentajat tyypit, sovellukset »

