Einstenio (t) rakenne, ominaisuudet, hankkiminen, käyttö

- 2000
- 84
- Alonzo Kirlin
Hän Einstenio Se on kemiallinen elementti, joka kuuluu aktiinidien tai aktinoidien luokkaan. Sen atomiluku on 99 ja sitä edustaa symboli. Se on synteettinen elementti, koska sitä ei ole löydetty mistään mineraalista tai maa -aineesta. Se löydettiin vuonna 1952 vetypumpun ensimmäisen räjähdyskokeen jäänteistä.
Aktinoidit ovat sarja, jonka ensimmäinen jäsen on aktinium ja jotka ovat osa puheluita Sisäiset siirtymäelementit. Einstenio on myös seitsemäs transurinen elementti, koska seitsemän paikkaa sijaitsee myöhemmin uraanissa elementtien jaksollisessa taulukossa.
 Symboli, atomisluku ja Einstenion vakioatomi -massa. ME/CC BY-SA (https: // creativecommons.Org/lisenssit/by-SA/2.5). Lähde: Wikimedia Commons.
Symboli, atomisluku ja Einstenion vakioatomi -massa. ME/CC BY-SA (https: // creativecommons.Org/lisenssit/by-SA/2.5). Lähde: Wikimedia Commons. Se on erittäin radioaktiivinen kiinteä kiinteä ja muodostuessaan alkaa hajottaa muiden elementtien muodostamisen, mikä on tehnyt sen tutkimisesta erittäin vaikeaa. Vaikka Einstenion mahdollisten isotooppien lukumäärä on suuri, vain alle 20% on löydetty.
Einsteniolla ei ole kaupallista käyttöä. Sitä tuotetaan hyvin pieninä määrinä ydinlaboratorioissa ja se on tarkoitettu vain tieteellisiin kokeisiin. Lisäksi tällaisten esseiden tutkijat käyttävät sitä hyvin harvoissa mikrogrammeissa ja asianmukaisilla varotoimenpiteillä, koska niiden säteilyaltistuminen on tappavaa.
[TOC]
Nimikkeistö
- Einstenio, kemiallinen symboli: se on
- Einstenio-253, ES-253 tai 253Se on: Einstenio -isotooppi atomimassalla 253.
Löytö
Alkuperä
Albert Ghiorso (Yhdysvaltain ydintieteilijä) ja heidän yhteistyökumppanit tunnistivat tämän elementin joulukuussa 1952 fragmenteissa, jotka ovat hajautettuina ensimmäisen vetypumppukokeen lämpöä räjähdyksessä.
Tämä H -pommi, nimeltään "Ivy Mike" ja myös "La Salachicha" sen muotoon, räjähti saman vuoden marraskuussa saarella, joka kuulu.
 Ivy Mike -vetypumpun räjähdys. TAI.S. Energia- / julkinen laitos. Lähde: Wikimedia Commons.
Ivy Mike -vetypumpun räjähdys. TAI.S. Energia- / julkinen laitos. Lähde: Wikimedia Commons. Sitä räjäyttämiseksi uraanin fissiopumppu oli käytetty. Viimeksi mainitun atomit vangitsivat useita neutroneja räjähdyksen aikana ja kärsivät beeta-rappeutumisen eri vaiheita, joista jokaisessa annetaan elektroni ja protoni, mikä johti Einstenio-253: n, ES: n isotooppiin, muodostumiseen.
Isotooppi on variantti samasta elementistä, jolla on erilainen määrä neutroneja atomin ytimessä, joten sillä on sama atomiluku (tässä tapauksessa 99), mutta erilainen atomimassa. Isotooppien lukumäärä osoittaa sen atomimassan.
Se voi palvella sinua: rikkitrioksidi (SO3): rakenne, ominaisuudet, riskit, käyttötarkoituksetLöydön julkaisu
Aluksi työ pidettiin salassa, mutta vuoden kuluttua kirjoittajat päättivät julkaista sen pelkääessään, että muut riippumattomat tutkijat voisivat tuottaa sen muissa laboratorioissa, hankkia löytön hyvitys ja antaa nimen elementille.
Joten marraskuusta 1953 maaliskuuhun 1954 he ilmoittivat neljä isotoopistaan. Lopuksi kesällä 1955 uuden Einstenio -elementin löytäminen atominumerolla 99 ilmoitettiin.
 Atomien ytimissä on protoneja ja neutroneja. Elementin isotoopit ovat samojen atomeja, joiden ytimessä on erilainen määrä neutroneja. Kirjoittaja: Gerd Altmann. Lähde: Pixabay.
Atomien ytimissä on protoneja ja neutroneja. Elementin isotoopit ovat samojen atomeja, joiden ytimessä on erilainen määrä neutroneja. Kirjoittaja: Gerd Altmann. Lähde: Pixabay. On tärkeätä huomata, että lämmönkirämän räjähdyksen näytteiden kerääminen väitti ensimmäisen luutnantin Jimmy Robinsonin, joka altistui näiden säteilylle.
Nimivalinta
"Einstenio" -nimi valittiin, koska Albert Einstein loi osan kvanttiteorian emäksistä, jotka sitten selittäisivät kuinka atomit ovat vuorovaikutuksessa toistensa kanssa.
Merkittävin asia nimensä esiintymisessä on sen kuuluisan yhtälön E = MC: n soveltaminen2, joka selittää massan muuntamisen energiaksi ihmisen luomissa tuhoisimmissa aseissa.
 Albert Einstein ei ollut samaa mieltä tieteen käytöstä tuhoisten aseiden luomiseen. Kirjoittaja: Stux. Lähde: Pixabay.
Albert Einstein ei ollut samaa mieltä tieteen käytöstä tuhoisten aseiden luomiseen. Kirjoittaja: Stux. Lähde: Pixabay. Löytön kirjoittajat ehdottivat, että elementillä oli "E" -symboli, mutta vuonna 1957 Pure and Applied Chemistry -yhtiön kansainvälinen liitto tai IUPAC (englanninkielinen lyhenne Kansainvälinen puhtaan ja sovelletun kemian liitto), muutti symbolin "on".
Elektroninen rakenne
Sen sähköinen kokoonpano on:
1s2; 2s2 2p6; 3s2 3p6 3d -d10; 4s2 4p6 4d -d10 4F14; 5s2 5p6 5d -d10; 6s2 6p6; 5Fyksitoista 7s2,
tai yhteenveto:
[RN] 5Fyksitoista 7s2,
Jos [RN] on jalo radonikaasun elektroninen rakenne (joka on myös radioaktiivinen).
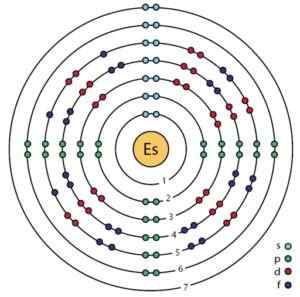 Einstenio -atomin orbitaalien ja elektronien kaavio parannetun BOHR -mallin mukaan. Ahatsardi.ScienceWriter/CC BY-SA (https: // creativecommons.Org/lisenssit/by-SA/4.0). Lähde: Wikimedia Commons.
Einstenio -atomin orbitaalien ja elektronien kaavio parannetun BOHR -mallin mukaan. Ahatsardi.ScienceWriter/CC BY-SA (https: // creativecommons.Org/lisenssit/by-SA/4.0). Lähde: Wikimedia Commons. Einstenio -ominaisuudet
Fyysinen tila
Metallinen kiinteä kiinteä kiinteä kiinteä.
Se voi palvella sinua: hopea -nitraatti (AGNO3): rakenne, ominaisuudet, käyttö, toksisuusAtomimassa
252 083
Sulamispiste
860 ºC
Kiehumispiste
996 ºC
Kemialliset ominaisuudet
Tutkia jtk 253Se osoittaa, että heidän käyttäytymis.
Joitakin hapettumistilan +3 yhdisteitä on karakterisoitu, kuten kloridi (SCL3), Bromuro (ESBR3), Yoduro (ESI3), oksikloridi (ESOCL) ja oksidi (se on2JOMPIKUMPI3-A.
 Kuva eintenio yodurosta, joka on otettu pimeässä. Valo johtuu radioaktiivisuuden päästöistä. Alamosin kansallinen laboratorio. / Julkinen alue. Lähde: Wikimedia Commons.
Kuva eintenio yodurosta, joka on otettu pimeässä. Valo johtuu radioaktiivisuuden päästöistä. Alamosin kansallinen laboratorio. / Julkinen alue. Lähde: Wikimedia Commons. Myös valenssit +2 ja +4 on kuitenkin ilmoitettu, vaikka niitä ei ole vahvistettu. Tässä tapauksessa se olisi Actinid -sarjan ensimmäinen kaksiarvoinen metalli.
Tämän elementin ja sen yhdisteiden x -kristallografiset tiedot on erittäin vaikea saada, koska sen spontaani hajoaminen tuottaa gammasäteilyä ja x -säteitä, jotka yliarvioivat instrumentin ilmaisinta ja kalvoa.
Isotoopit
Toistaiseksi 19 ES: n isotooppia on löydetty atomimassoilla välillä 241 - 257 ja 3 isomeeriä. Kukaan ei ole vakaa. Kaikista mahdollisista Einstenio -isotooppeista on kuitenkin tuotettu ja tunnistettu alle 20%.
Sen vakain isotooppi on Eintenio-252, jonka puoliintumisaika on 471,7 päivää. Berkelio-248 hajoaa alfahiukkasen liikkeeseenlaskun kautta (muodostettu 2 protonia ja 2 neutronia) tai siitä tulee Californio-252 sieppaamalla elektronia.
Nykyinen hankkiminen
Nykyään Einstenio tuottaa pitkän ydinreaktioketjun, joka sisältää kunkin ketjun isotoopin pommituksen neutronien kanssa ja lopulta tuloksena oleva isotooppi kärsii rappeutumisktaasta.
Atomin ytimessä rappeutumis- tai deintegraatiobeeta -beeta säteilee beetapartikkelia, joka voi olla elektroni tai positroni, tasapainottaakseen atomin ytimessä olevan neutron/protonisuhteen tasapainottamiseksi atomin ytimessä.
Menettely
Yhdysvalloissa Oak Ridge Laboratories on siellä Korkean flux -isotooppireaktori-A. Mikrogrammi on miljoonan gramman, ts. Se vastaa 0,000001 grammaa.
Voi palvella sinua: tiolesMenetelmä on ollut seuraava:
- Useiden vuosien ajan suuria määriä (kilogrammia) 239PU (Polonio-239) tuottaa 242Puku.
- Se 242PU plutoniumoksidissa ja sekoitettu alumiinioksidin kanssa2JOMPIKUMPI3 Pakattujen pallojen muodostaminen.
- Materiaalin alueet sisällytettiin erityisiin baareihin, jotka säteilytettiin vuoden ajan Savannah -joen tehtaalla Yhdysvalloissa.
- Sitten palkit säteilyttiin HFIR: ssä vielä 4 kuukautta.
- Lopuksi tuloksena olevalle materiaalille tehtiin kemialliset toimenpiteet Einstenion erottamiseksi Californio -isotoopista (ES: n pojat).
 Atomin ydin. Poloniumydin pommitetaan neutroneilla osana menettelyä Einstenion saamiseksi. Kirjailija: Clker-Vector-kuvat. Lähde: Pixabay.
Atomin ydin. Poloniumydin pommitetaan neutroneilla osana menettelyä Einstenion saamiseksi. Kirjailija: Clker-Vector-kuvat. Lähde: Pixabay. HFIR: n erityisoperaatioissa ne voidaan saada Einstenion noin 2 milligrammaa (MG).
Sovellukset
Tämä elementti on esiintynyt vain hyvin pieninä määrinä, se on myös erittäin radioaktiivinen, joten sillä ei ole kaupallista käyttöä. Sillä on tällä hetkellä sovellusta vain tieteellisessä tutkimuksessa.
Hankkimalla Mendelevio
Vuonna 1961 makroskooppinen määrä 253Se on paino 0,01 mikrogrammaa (μg) mitattuna erityisellä magneettisella tasapainolla. Tätä näytettä pommitettiin sitten neutroneilla Mendelevio -elementin tuottamiseksi (atominumero 101).
Säteilyn vaikutuksia koskevissa tutkimuksissa
Intensiivistä einstenio -säteilyn itsepäästöä voidaan käyttää tutkimaan nopeutettua ikääntymistä ja säteilyn aiheuttamia vaurioita.
 Säteily, jonka säteilee Einstenio-253. Kuva otettu pimeässä. Haire, r. G., Yhdysvaltain energiaministeriö.Materiaalitieteilijä koskettaa sisään.Wikipedia. / Julkinen alue. Lähde: Wikimedia Commons.
Säteily, jonka säteilee Einstenio-253. Kuva otettu pimeässä. Haire, r. G., Yhdysvaltain energiaministeriö.Materiaalitieteilijä koskettaa sisään.Wikipedia. / Julkinen alue. Lähde: Wikimedia Commons. Sitä on esimerkiksi käytetty tutkimuksissa radioaktiivisen hajoamisen kemiallisista seurauksista.
ES-253: n suhteellisen lyhyen puoliintumisajan (20,47 päivää) johtuen voit tutkia sen Sonotopo-pojan BK-249: n sisäistä kasvua, jonka puoliintumisaika on 330 päivää että pojanpojan CF-249 (Life keskimäärin 351 vuotta).
Tietyt tiedot viittaavat siihen, että hän on kaksiarvo, joka voi pudota kaksiarvoiseen kaksiarvoon kaliporn (edelleen tuntematon).
Kemiallisissa ja fysikaalisissa tutkimuksissa
Se on raskain elementti, jolla voidaan suorittaa tutkimuksia, mikä mahdollistaa perustutkimuksen kehittämisen elektronien roolista 5F Aktiinidien organisaatiossa ja luokituksessa.
ES-252 on saatavana vain vähimmäismäärinä. Isotoopit ES-253 (puoliintumisaika 20,47 päivää) ja ES-254: llä (275,7 päivää) on pidempi puoliintumisaika ja niiden saatavuus on parempi, joten niitä käytetään fysikaalis-kemiallisissa tutkimuksissa.
Kokeissa käytetään kuitenkin vain muutamia mikrogrammia (μg) työntekijöiden altistumisen vähentämiseksi ja intensiivisen itsensä säteilyn vaikutukset minimoimaan.
 Einstenio on erittäin vaarallinen, koska se on voimakkaasti radioaktiivinen elementti. Kirjailija: Clker-Vector-kuvat. Lähde: Pixabay.
Einstenio on erittäin vaarallinen, koska se on voimakkaasti radioaktiivinen elementti. Kirjailija: Clker-Vector-kuvat. Lähde: Pixabay. Mahdollinen käyttö lääketieteessä
Arvioidaan, että sitä voidaan käyttää säteilylääketieteellisiin hoitomuotoihin, jotka on suunnattu tietyille elimille.
Viitteet
- Lyijy, d.R -. (Toimittaja) (2003). CRC: n kemian ja fysiikan käsikirja. 85th CRC -lehdistö.
- Pubchem (2020). Einsteinium - on (elementti). PubChemistä toipunut.NCBI.Nlm.NIH.Hallitus.
- Puuvilla, f. Albert ja Wilkinson, Geoffrey. (1980). Edistynyt epäorgaaninen kemia. Neljäs painos. John Wiley & Sons.
- Meierfrankenfeld, D. et al. (2011). Skandiumin, titaanin, elohopean ja Einsteinium -isotooppien löytäminen. Atomitiedot ja ydintietotaulut 97 (2011) 134-151. ScienEdirect.com.
- Kuninkaallinen kemian yhdistys. (2020). Einsteinium. RSC toipunut.org.
- Ross, r. (2017). Faktoja Einsteiniumista. Toipunut LivesCience.com.
- « Sekoitetut yritykset ominaisuudet ja esimerkit
- Kohdemarkkinoiden ominaisuudet, tyypit, miten se määritellään, esimerkkejä »

