Differentiaalielektroni

- 3798
- 1047
- Eddie Hackett
Hän differentiaalielektroni o Erottelija on viimeinen elektroni, joka on sijoitettu atomin elektronisen konfiguraation sekvenssiin. Mikä sinun nimesi on? Tähän kysymykseen vastaamiseksi on välttämätöntä tietää atomin perusrakenne: sen ydin, tyhjä ja elektronit.
Ytim on tiheä ja kompakti positiivisten hiukkasten aggregaatti, jota kutsutaan protoneiksi, ja neutraaleiksi hiukkasiksi, joita kutsutaan neutroneiksi. Protonit määrittelevät atomiluku z: n ja muodostavat yhdessä neutronien kanssa atomimassan. Atomilla ei kuitenkaan voi olla vain positiivisia maksuja; Siksi elektronit kiertävät ytimen ympärillä sen neutraloimiseksi.
 Perusatomirakenne: Main Subatomiset hiukkaset
Perusatomirakenne: Main Subatomiset hiukkaset Siten jokaiselle ytimeen lisäävälle protonille uusi elektroni sisällytetään sen kiertoradalle kasvavan positiivisen varauksen torjumiseksi. Tällä tavoin uusi lisätty elektroni, differentiaalielektroni, liittyy läheisesti atominumeroon z.
Differentiaalielektroni löytyy uloimmasta elektronisesta kerroksesta: Valencia -kerros. Siksi mitä edelleen ydin on, sitä suurempi siihen liittyvä energia. Tämä energia on vastuussa sen osallistumisesta, samoin kuin muiden Valencia -elektronien, elementtien ominaisten kemiallisissa reaktioissa.
[TOC]
Kvantinumerot
Muiden elektronien lisäksi differentiaalielektroni voidaan tunnistaa sen neljällä kvantinumerolla. Mutta mitkä ovat kvanttinumerot? Ne ovat "n", "l", "m" ja "s".
Kvantinumero "N" tarkoittaa atomin ja energiatasojen kokoa (k, l, m, n tai, p, q). "L" on sekundaarinen tai acemutaalinen kvanttiluku, joka osoittaa atomiorbitaalien muodon ja ottaa arvot 0, 1, 2 ja 3 kiertoradalle "S", "P", "D" ja "F ", vastaavasti.
Se voi palvella sinua: Amphorated Flask: Ominaisuudet, mitä se on, tyypit, käyttö"M" on magneettinen kvanttiluku ja osoittaa kiertoratojen alueellisen suuntauksen magneettikentän alla. Siten 0 kiertoradalle "S"; -1, 0, +1, kiertoradalle "p"; -2, -1, 0, +1, +2, kiertoradalle “d”; ja -3, -2, -1, 0, +1, +2, +3, kiertoradalle “F”. Lopuksi, Spin “S”: n kvanttimäärä (+1/2 ↑: lle ja -1/2 ↓: lle).
Siksi differentiaalielektroni on yhdistänyt aikaisemmat kvantinumerot ("n", "l", "m", "s"). Koska se torjuu uuden protonin tuottaman uuden positiivisen kuorman, se tarjoaa myös elementin atominumeron Z.
Kuinka tietää differentiaalielektroni?
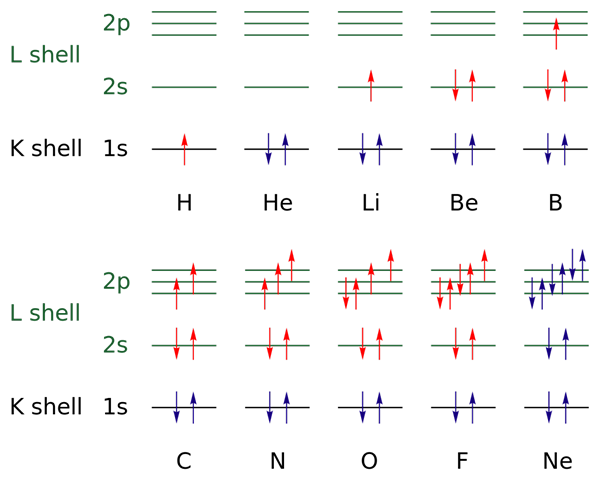
Yläkuvassa elektroniset kokoonpanot esitetään elementeille vedystä neonikaasuun (H → NE).
Tässä avoimien kerrosten elektronit on merkitty punaisella värillä, kun taas suljettujen kerrosten elektronit on merkitty sinisellä värillä. Kerrokset viittaavat kvantinumeroon "n", ensimmäinen neljästä.
Tällä tavoin H (punaisen ↑) Valencia -konfiguraatio lisää toisen elektronin, jolla on vastakkainen suunta, tullakseen HE: n (↓ ↑, molemmat siniset, koska nyt taso 1 on suljettu). Tämä lisätty elektroni on sitten differentiaalielektroni.
Siten voidaan havaita, kuinka differentiaalielektroni lisää valenssikerroksen (punaiset nuolet) elementeistä, erottaen ne toisistaan. Elektronit täyttävät uppoamisääntöä kunnioittavat kiertoradat ja Paulingin poissulkemisperiaate (havaittu täydellisesti B: stä NE: hen).
Ja entä kvantinumerot? Ne määrittelevät jokaisen nuolen - eli kukin elektronit - ja sen arvot voidaan vahvistaa elektronisen kokoonpanon kanssa tietääkseen, ovatko differentiaalielektronin arvot vai eivät vai eivät.
Se voi palvella sinua: mitkä ovat negatiiviset vaikutukset veden liukoisuuteen?Esimerkkejä erilaisista elektroneista useissa elementeissä
Kloori
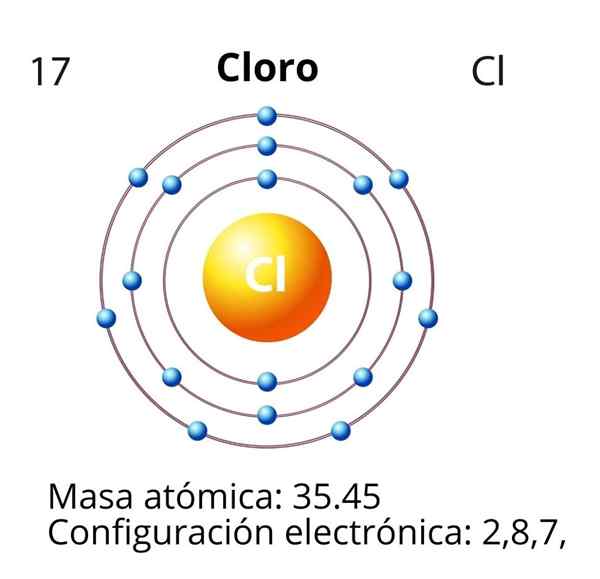
Kloorin (CL) tapauksessa sen atomiluku z on yhtä suuri kuin 17. Sähköinen kokoonpano on sitten 1s22s2SP63s23P5. Punaisella merkityt orbitaalit vastaavat Valencia -kerroksen, joka esittelee tason 3 avoinna.
Differentiaalielektroni on viimeinen elektroni, joka on sijoitettu elektroniseen kokoonpanoon, ja klooriatomi on 3P -kiertoradan, jonka sijoitus on seuraava:
↑ ↓ ↑ ↓ ↑ _
3px 3PY 3PZ
(-1) (0) (+1)
Allas -säännön kunnioittaminen 3P -kiertoradalla täytetään ensin yhtä suurella energialla (ylöspäin suuntautuva nuoli jokaisessa kiertoradalla). Toiseksi muut elektronit pariutuvat yksinäisten vasemmalla oikealla elektronilla. Differentiaalielektroni on esitetty vihreässä kehyksessä.
Siten kloorin differentiaalielektronilla on seuraavat kvantinumerot: (3, 1, 0, -1/2). Eli "n" on 3; "L" on 1, kiertorata "P"; "M" on 0, koska se on väliaineen kiertoradan "P"; Ja "s" on -1/2, koska nuoli osoittaa.
Magnesium
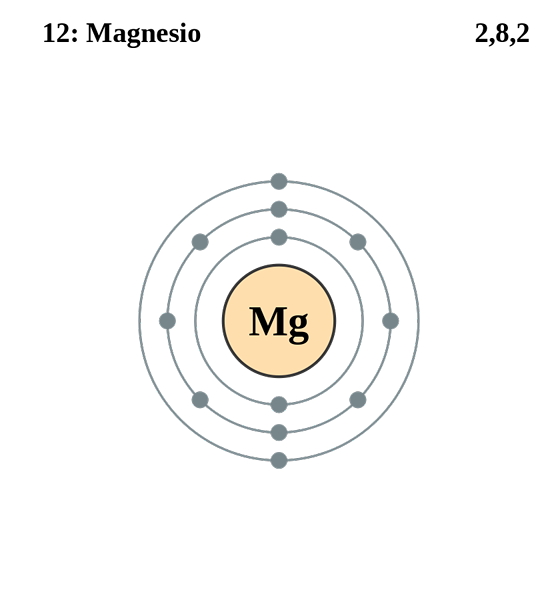 Elektroninen magnesiumkokoonpano. Lähde: Electron_shell_012_magnesium.SVG: Pumbaa (Greg Robsonin alkuperäinen teos) Johdannainen: Kizar, CC BY-SA 3.0, Wikimedia Commons
Elektroninen magnesiumkokoonpano. Lähde: Electron_shell_012_magnesium.SVG: Pumbaa (Greg Robsonin alkuperäinen teos) Johdannainen: Kizar, CC BY-SA 3.0, Wikimedia Commons Magnesiumiatomin elektroninen kokoonpano on 1s22s2SP63s2, Edustavat kiertorata ja sen Valencia -elektronia samalla tavalla:
↑ ↓
3s
0 -
Tällä kertaa differentiaalielektronilla on kvanttilukut 3, 0, 0, -1/2. Ainoa ero tässä tapauksessa kloorin suhteen on, että kvanttiluku "L" on 0, koska elektroni vie kiertoradan "S" (3S).
Zirkonio
Zirkonium -atomin (siirtymämetalli) elektroninen konfiguraatio on 1s22s2SP63s23P64S23D104P65s24D2. Samoin kuin aiemmat tapaukset, Valencian kiertoratojen ja elektronien esittäminen on seuraava:
Se voi palvella sinua: Cyclopentano (C5H10): rakenne, ominaisuudet ja käytöt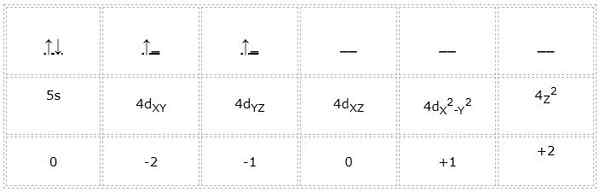
Siten vihreälle merkittyyn differentiaalielektroniin liittyvät kvantinumerot ovat: 4, 2, -1, +1/2. Täällä, kun elektroni vie toisen kiertoradan "D", sen kvanttiluku "M" on yhtä suuri kuin -1. Koska nuoli osoittaa, sen spin -luku "S" on yhtä suuri kuin +1/2.
Tuntematon elementti
Erilaisten elektronin kvanttinumerot tuntemattomalle elementille ovat 3, 2, +2, -1/2. Mikä on elementin atominumero Z? Tietäen, että z voi salata, mikä elementti on.
Tällä kertaa, koska "N" on sama 3, se tarkoittaa, että elementti on jaksollisen taulukon kolmannella jaksolla, "D" -orbitaalien ollessa Valencia -kerroksena ("l" yhtä suuri kuin 2). Siksi orbitaalit esitetään kuten edellisessä esimerkissä:
↑ ↓ ↑ ↓ ↑ ↓ ↑ ↓ ↑ ↓
Kvantinumerot "M", joka on yhtä suuri kuin +2 ja "S", joka on yhtä suuri kuin -1/2, ovat avain erilaisten elektronien oikein löytämiseen viimeisessä 3D -kiertoradalla.
Siten etsittyllä elementillä on 3D -kiertorataa10 Täysin, kuten sen sisäiset elektroniset kerrokset. Yhteenvetona voidaan todeta, että elementti on metalli sinkki (Zn).
Eroelektronin kvantinumero ei kuitenkaan voi havaita sinkin ja kuparin välillä, koska tämä viimeinen elementti esittelee myös 3D -orbitaalit täynnä. Koska? Koska kupari on metalli, joka epäonnistuu elektroneilla täytettyjen sääntöjen kanssa kvanttisyistä.
Viitteet
- Jim Branson. (2013). Pesuallassäännöt. Haettu kvanpumekaniikasta.UCSD.Edu
- Luento 27: Sinkin säännöt. Pinnasta palautettu.Qmul.Ac.Yhdistynyt kuningaskunta
- Purduen yliopisto. Kvanttinumerot ja elektronikokoonpanot. Haettu Murmedista.Kemia.Purduke.Edu
- Salvat -tieteen tietosanakirja. (1968). Salvat -fysiikka, S.-Lla. of Pamplona Editions, osa 12, Espanja, s. 314-322.
- Walter J. Moore. (1963). Fysikaalinen kemia. Sisään Hiukkaset ja aallot. Neljäs painos, Longmans.

