Metallinen merkki
- 3035
- 861
- Juan Breitenberg V
Mikä on metallinen hahmo?
Hän Elementtien metallinen luonne Määräaikaiset taulukossa viitataan kaikkiin muuttuviin, kemiallisiin ja fysikaalisiin, jotka määrittelevät metallit tai erottavat ne muista luonnon aineista. Ne ovat yleensä kirkkaita, tiheitä, kovia, korkeat lämpö- ja sähkö-, muovattavat ja pallokevat johtavuudet.
Kaikilla metalleilla ei kuitenkaan ole sellaisia ominaisuuksia; Esimerkiksi elohopean tapauksessa tämä on kirkkaan musta neste. Nämä muuttujat riippuvat myös maanpäällisistä paine- ja lämpötilaolosuhteista. Esimerkiksi ilmeisesti ei -metallinen vety voi käyttäytyä fyysisesti metallina äärimmäisissä olosuhteissa.
Nämä olosuhteet voivat olla: absoluuttisen nollan ympärillä olevat epämiellyttävät paineet tai erittäin kylmät lämpötilat. Jotta voitaisiin määritellä, onko elementti metallinen vai ei, on tarpeen harkita piilotettuja kuvioita tarkkailijan silmissä: atomikuviot.
Nämä syrjivät tarkempaa tarkkuutta ja luotettavuutta, mitkä ovat metallielementit ja jopa mikä elementti on metallisempi kuin toinen.
Tällä tavoin kultakolikon todellinen metallinen luonne lepää enemmän sen atomien ominaisuuksista kuin sen kultaisen massan perusteella, jopa molemmat ovat läheisesti yhteydessä toisiinsa.
Mikä kolikoista on metallisempi: yksi kullan, kuparista tai platinasta? Vastaus on platina, ja selitys on sen atomeissa.
Kuinka vaihtelee elementtien metallista luonnetta jaksollisessa taulukossa?
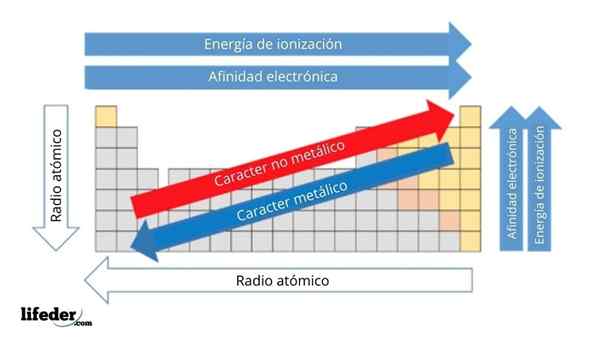
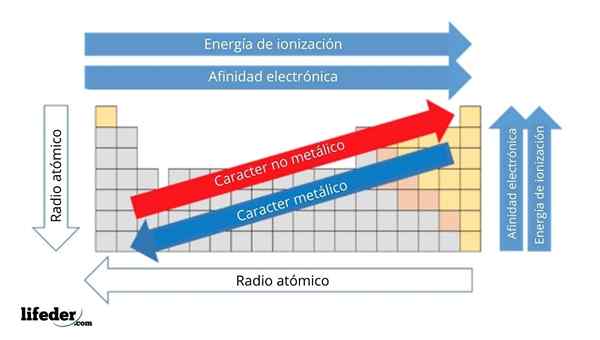
Yläkuvassa sinulla on elementtien jaksolliset ominaisuudet. Rivit vastaavat ryhmien ajanjaksoja ja sarakkeita.
Metallinen luonne vähenee jaksollisen taulukon vasemmalta oikealle ja kasvaa vastakkaiseen suuntaan. Samoin metallinen luonne kasvaa ylhäältä alas ja vähenee, kun ajanjaksot kulkevat ryhmäpäälle.
Se voi palvella sinua: emäkset: ominaisuudet ja esimerkitTällä tavoin elementeillä, jotka ovat lähellä suuntaa, johon nuolipisteet, on suurempi metallinen luonne kuin vastakkaiseen suuntaan (keltaiset lohkot) sijaitsevat (keltaiset lohkot).
Lisäksi muut nuolet vastaavat muita jaksollisia ominaisuuksia, jotka määrittelevät missä mielessä ne kasvavat tai vähenevät, koska elementti on "metallinen". Esimerkiksi keltaisten lohkojen elementit, vaikka niillä on alhainen metallinen luonne, niiden elektroninen affiniteetti- ja ionisaatioenergia ovat korkeat.
Atomisradioiden tapauksessa mitä suurempi, sitä metallisempi elementti on; Tätä osoittaa sininen nuoli.
Metallisten elementtien ominaisuudet
Jaksollisessa taulukossa havaitaan, että metalleilla on suuret atomiradiot, matala ionisaatioenergiat, alhaiset elektroniset affiniteetit ja matala elektronegativiteetti. Kuinka muistaa kaikki nämä ominaisuudet?
Piste, johon ne virtaavat, on reaktiivisuus (sähköpositiivisuus), joka määrittelee metallit, jotka hapettuu; eli he menettävät elektronit helposti.
Kun he menettävät elektronit, metallit muodostavat kationeja (m+-A. Siksi elementit, joilla on korkein metallinen luonne, muodostavat kationit helpommin kuin alhaisemman metallisen luonteen elementit.
Esimerkki yllä olevasta on harkita ryhmän 2 elementtien reaktiivisuutta, alkalinottimet metallit. Beryllium on vähemmän metallinen kuin magnesium, ja tämä puolestaan on vähemmän metallinen kuin kalsium.
Joten kunnes saavutetaan metalli Bario, ryhmän reaktiivisin (säteen jälkeen, radioaktiivinen elementti).
Kuinka metallien reaktiivisuuden atomisäde vaikuttaa?
Atomisisäteen lisääntyessä Valencian elektronit ovat kauempana ytimestä, joten ne säilytetään vähemmän voimalla atomista.
Voi palvella sinua: natriumhydroksidi (NaOH): rakenne, ominaisuudet, käytöt, synteesiJos ajanjakso kuitenkin kulkee jaksollisen taulukon oikealle puolelle, ydin lisää protoneja vartaloonsa, nyt positiivisempaa, mikä houkuttelee valenssielektroneja voimakkaammin, vähentäen atomisäteen kokoa. Tämä johtaa metallisen merkin vähentymiseen.
Siten hyvin pieni atomi ja erittäin positiivisella ytimellä on taipumus saada elektroneja sen sijaan, että menettäisivät niitä (ei -metallia), että niitä, jotka voivat sekä voittaa että menettää elektroneja, pidetään metalloidesina. Boori, pii, saksa ja arseeni ovat joitain näistä metalloideista.
Toisaalta atomisäde kasvaa myös, jos muille kiertoradalle on uusi energian saatavuus, joka tapahtuu ryhmässä laskeutuessa.
Tästä syystä, kun laskeutuessaan jaksollisessa taulukossa, radioista tulee tilaa vieviä ja ydin ei kykene estämään muita lajeja sieppaamasta elektroneja ulkokerroksestaan.
Laboratoriossa voimakkaasti hapettavan aineen kaltaisella laimennetulla typpihapolla (HNO3)- Metallin reaktiivisuus hapettumisen edessä voidaan tutkia.
Samoin niiden metallihalogenidien muodostumisprosessit (esimerkiksi NaCl) ovat myös tämän reaktiivisuuden demonstratiivisia kokeita.
Suuremman metallisen merkin elementti
 Cesium
Cesium Sinisen nuolen suunta jakson taulukon kuvaan johtaa Francio- ja Cesio -elementteihin. Francio on metallisempi kuin cesium, mutta toisin kuin jälkimmäinen, Francio on keinotekoinen ja radioaktiivinen. Tästä syystä Cesium käyttää suuremman metallisen luonteen luonnollisen elementin paikkaa.
Voi palvella sinua: rautaoksidiItse asiassa yksi tunnetuimmista (ja räjähtävistä) tunnetuista reaktioista on se, joka tapahtuu, kun cesiumin pala (tai tippaa) joutuu kosketukseen veden kanssa.
Cesiumin korkea reaktiivisuus, joka myös muuttuu paljon vakaampien yhdisteiden muodostumiseen, on vastuussa energian äkillisestä vapautumisesta:
2C (t) + 2H2O → 2CSOH (AQ) + H2(g)
Kemiallinen yhtälö sallii nähdä cesiumin hapettumisen ja veden vedyn pelkistämisen kaasumaiseksi vedeksi.
Alemman metallisen merkin elementti
 3D -fluorimalli
3D -fluorimalli Vastakkaisessa diagonaalissa, jaksollisen taulukon oikeassa yläkulmassa, fluori (F2, ylivoimainen kuva) johtaa ei -metallisista elementtien luettelosta. Koska? Koska se on elementti elektronegatiivisimmassa luonteessa ja sellainen, jolla on alhaisin ionisaatioenergia.
Toisin sanoen, se reagoi kaikkien jaksollisen taulukon elementtien kanssa ionin F muodostamiseksi- eikä f+.
Fluori ei todennäköisesti menetä elektroneja jossain kemiallisessa reaktiossa, aivan metallien vastaisesti. Tästä syystä se on alemman metallisen merkin elementti.
Viitteet
- Lumen, ei-majorien kemia. Metallinen ja ei -metalllinen merkki. Toipunut kurssilta.Lumenarning.com
- Kemian tehtävä. (2018). Elektroopostisiteetti tai metallinen merkki. Kemian ja.com
- Juan Ramos. Täydellinen luettelo metalleista ja ei -metalleista. Sciencetrends.com
- Anne Marie Helmestine, PH.D -d. Metalliset luonteen ominaisuudet ja trendit. Toipunut Ajatelukyvystä.com

