Elektronegatiivisuus
- 1660
- 136
- Alonzo Kirlin
Mikä on elektronegatiivisuus?
Se Elektronegatiivisuus Se on suhteellinen jaksollinen ominaisuus, joka koskee molekyyliympäristön elektronisen tiheyden houkuttelemisen kykyä. Tämä on atomin suuntaus houkutella elektroneja itseensä, kun se on kiinnitetty molekyyliin. Tämä heijastuu monien yhdisteiden käyttäytymisessä ja kuinka molekyylien välinen vuorovaikutus on toistensa kanssa.
Toisin sanoen, mitä enemmän elektronegatiivista se on atomi, sitä suurempi kyky houkutella muiden atomien elektroneja; Sillä on myös korkeampi ionisaatiopotentiaali, jonka avulla voit ylläpitää elektronejasi ulkoisen vetovoiman edessä houkuttelemalla ympäröivien atomien elektroneja.
Nyt kaikki elementit eivät houkuttele vierekkäisiä atomien elektroneja samassa määrin. Niiden, jotka tuottavat elektronista tiheyttä, sanotaan, että he ovat elektropositiivinen, Kun taas ne, jotka "peittävät" elektronit ovat elektronegatiivit. Tämä ominaisuus (tai käsite) on monia tapoja selittää ja tarkkailla.
Esimerkiksi molekyylin sähköstaattisten potentiaalien karttoissa (kuten ylemmän kuvan klooridioksidi, CLO2) Havaitaan kloorin ja happiatomien erilaisten elektronegativiteettien vaikutus.
Punainen väri osoittaa molekyylin, Δ- ja elektronien köyhien siniset värien runsaat alueet, δ+. Siten laskennallisten laskelmien jälkeen tämäntyyppiset kartat voidaan määrittää; Monet heistä osoittavat suoran suhteen sähkövaiheiden atomien ja δ: n välillä-.
Se voidaan myös visualisoida seuraavasti: molekyylissä on todennäköisempää, että elektronien kuljetus tapahtuu eniten elektronegatiivisten atomien läheisyydessä.
Tästä syystä CLO: lle2 Happiatomeja (punaisia palloja) ympäröi punainen pilvi, kun taas sinertävän pilven klooriatomi (vihreä pallo).
Elektronegatiivisuuden määritelmä riippuu ilmiölle annetusta lähestymistavasta, on olemassa useita asteikkoja, jotka ottavat sen huomioon eri näkökohdista. Kaikilla asteikoilla on kuitenkin yhteinen, että atomien luontainen luonne tukee niitä.
Elektronegatiivisuusasteikot
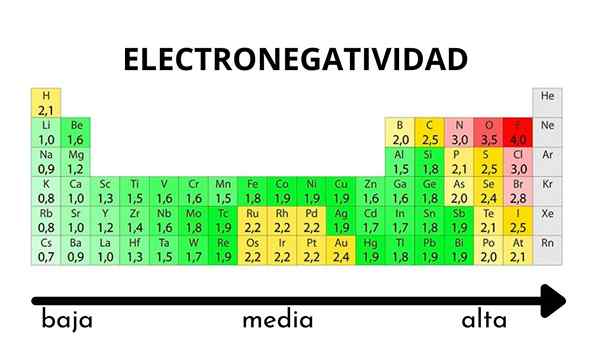
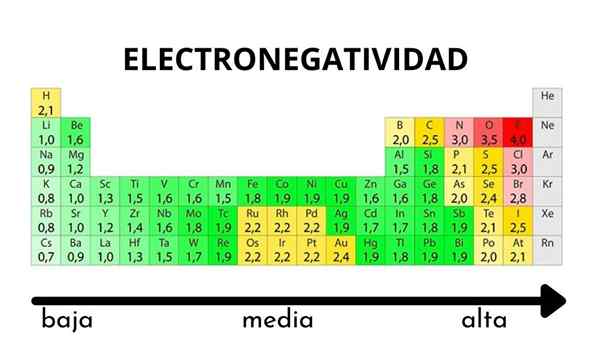 Jaksollisessa taulukossa se voidaan havaita, kun elektronegatiivisuuden arvo kasvaa tai vähenee
Jaksollisessa taulukossa se voidaan havaita, kun elektronegatiivisuuden arvo kasvaa tai vähenee Elektronegatiivisuus ei ole ominaisuus, joka voidaan määrittää, eikä sillä ole absoluuttisia arvoja. Tämä johtuu siitä, että trendi atomin houkuttelemisesta elektronisen tiheyden häntä kohtaan ei ole sama kaikissa yhdisteissä. Toisin sanoen: elektronegatiivisuus vaihtelee molekyylin mukaan.
Jos Clo -molekyyli2 CL: n atomi vaihdetaan n: ksi, silloin myös elektronien tai houkuttelemisen taipumusta muutetaan; Sitä voitaisiin lisätä (saada punainen pilvi) tai lasku (menetä väri). Ero olisi muodostettu uudessa N-O-linkissä, jotta saadaan O-N-O2-A.
Se voi palvella sinua: kemian ja tekniikan suhde ihmisen, terveyden ja ympäristön kanssaKoska atomin elektronegatiivisuus ei ole sama kaikissa sen molekyyliympäristöissä, on välttämätöntä määritellä se muiden muuttujien mukaan. Tällä tavoin on arvoja, jotka toimivat referenssinä ja jotka sallivat ennustamisen esimerkiksi muodostetun linkin tyypin (ioninen tai kovalenttinen).
Pauling -asteikko
Kahden Nobel-palkinnon suuri tutkija ja voittaja, Linus Pauling (1901-1994), nostettu vuonna 1932 kvantitatiivinen (mitattavissa) elektronegatiivisuuden muoto, joka tunnetaan nimellä Pauling-asteikko. Siinä kahden elementin, A: n ja B: n elektronegatiivisuus, muodostuvat linkit, liittyi ylimääräiseen energiaan, joka liittyy A-B-linkin ioniseen luonteeseen.
Teoreettisesti kovalenttiset sidokset ovat vakaimmat, koska niiden elektronien jakautuminen kahden atomin välillä on oikeudenmukaista; eli A-A- ja B-B-molekyyleille molemmat atomit jakavat sidoselektronit samalla tavalla. Kuitenkin, jos A on enemmän elektronegatiivista, niin sanoi, että pari on enemmän kuin B.
Tällöin A-B ei ole enää täysin kovalenttinen, vaikka sen elektronegativiteetti ei eroa paljon, voidaan sanoa, että sen linkillä on korkea kovalenttinen merkki. Kun näin tapahtuu, linkki läpikäy pienen epävakauden ja saa ylimääräistä energiaa A: n ja B: n elektronegatiivisuuseron tuotteena.
Mitä suurempi tämä ero on, sitä enemmän A-B-linkin energiaa ja sen vuoksi sitä suurempi mainitun linkin ioninen luonne.
Tämä asteikko edustaa eniten käytettyä kemiassa, ja elektronegatiivien arvot syntyivät 4: n arvon allokoinnista fluoriatomille (elementti, jolla on alhaisin elektronegatiivisuus, on cessium, 0,7). Sieltä he voisivat laskea muiden elementtien.
Mulliken -asteikko
Vaikka Pauling-asteikko liittyy linkkiin liittyvään energiaan, Robert Mulliken -asteikko (1896-1986) liittyy enemmän kahteen muuhun jaksolliseen ominaisuuteen: ionisaatioenergia (EI) ja elektroninen affiniteetti (AE).
Siten elementti, jolla on korkeat arvot EI: n ja AE: n arvot, on erittäin elektronegatiivinen, ja siksi se houkuttelee elektroneja sen molekyyliympäristöstä.
Koska? Koska se heijastaa, kuinka vaikeaa on "aloittaa" ulkoinen elektroni ja kuinka vakaa kaasufaasissa muodostettu anioni on niin vakaa. Jos molemmilla ominaisuuksilla on korkeat suuruudet, elementti on "rakastaja" elektronien "rakastaja".
Voi palvella sinua: FusionMulliken -elektronegativiteetti lasketaan seuraavalla kaavalla:
ΧM = ½ (EI + AE)
Eli χM Se on yhtä suuri kuin EI: n ja AE: n keskiarvo.
Toisin kuin Pauling -asteikko, joka riippuu siitä, mitkä atomit muodostavat linkit, tämä liittyy Valencian tilan ominaisuuksiin (sen vakaimmilla elektronisilla kokoonpanoilla).
Molemmat asteikot tuottavat samanlaisia elektronegatiivisuusarvoja elementeille ja liittyvät suunnilleen seuraavaan muuntamiseen:
ΧP = 1.35 (χM-A1/2 - 1.37
Molemmat xM kuten xP Ne ovat mitattomia arvoja; Eli heillä ei ole yksiköitä.
A -asteikko a.Lens. Allred ja E. Rochow
On myös muita elektronegatiivisuuden asteikkoja, kuten Sanderson ja Allen. Kaksi ensimmäistä seuraa kuitenkin Allred- ja Rochow -asteikko (χAR-A. Tämä asteikko perustuu tehokkaaseen ydinkuormaan, jonka elektroni kokee atomien pinnalla. Siksi se liittyy suoraan ytimen houkuttelevaan voimaan ja näyttövaikutukseen.
Kuinka vaihtelee elektronegatiivisuutta jaksollisessa taulukossa?
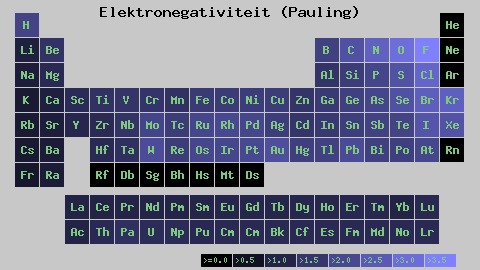 Pauling Electronegatiivisuusasteikko. Lähde: Wikimedia Commons
Pauling Electronegatiivisuusasteikko. Lähde: Wikimedia Commons Riippumatta sen asteikoista tai arvoista, elektronegatiivisuus kasvaa oikealta vasemmalle ajanjaksolle ja ryhmien alhaalta ylöspäin. Siten se kasvaa kohti oikeaa yläkulmaa (ei lasketa heliumia) ennen kuin fluori on.
Superior -kuvassa vasta sanottu. Määräaikaisessa taulukossa Pauling -elektronegativiteetti ilmaistaan laatikoiden värien mukaan. Koska fluori on elektronegatiivisin, se on sen mukaan karkeampi violetti väri, kun taas vähemmän elektronegatiiviset (tai elektropositiiviset) värit tummempia.
Voidaan myös nähdä, että ryhmäpäät (h, be, b, c jne.) Heillä on selkeimmät värit, ja kun muut elementit ovat peräisin ryhmästä. Mitä tämä on? Vastaus on jälleen EI, AE, ZEF (tehokas ydinkuormitus) -ominaisuudet ja atomisäteellä.
Atomi molekyylissä
Yksittäisillä atomeilla on todellinen ydin z ja ulkoiset elektronit kärsivät tehokkaasta ydinkuormitustuotteesta suojausvaikutuksesta.
Kun se liikkuu ajanjakson aikana, ZEF kasvaa siten, että atomi tehdään; toisin sanoen atomiradiot vähenevät koko ajanjakson ajan.
Tämä johtaa siihen, että yhden atomin yhdistämishetkellä toisen kanssa elektronit "virtaavat" atomiin suuremmalla ZEF: llä. Tämä antaa myös linkille ionisen merkin, jos elektronien merkitty suuntaus atomiin,. Kun ei, puhuu pääasiassa kovalenttisesta sidoksesta.
Voi palvella sinua: Violet lasiTästä syystä elektronegatiivisuus vaihtelee atomiradioiden, ZEF: n mukaan, mikä puolestaan liittyy läheisesti EI: hen ja AE: hen. Kaikki on ketju.
Elektronegatiivisuuden hyödyllisyys
Elektronegatiivisuus palvelee periaatteessa sen määrittämistä, onko binaarinen yhdiste kovalenttinen vai ioninen. Kun elektronegatiivisuusero on erittäin korkea (nopeudella 1.7 yksikköä tai enemmän) sanotaan, että yhdiste on ioninen.
On myös hyödyllistä erottaa rakenteessa, jonka alueet ovat mahdollisesti rikkaampia elektroneissa.
Tästä eteenpäin voidaan ennustaa, mikä mekanismi tai reaktio voi kärsiä yhdisteestä. Elektronien köyhillä alueilla, Δ+, on mahdollista, että negatiivisesti varautuneet lajit saadaan tietyllä tavalla; Ja elektroneja runsailla alueilla niiden atomit voivat olla vuorovaikutuksessa hyvin erityisillä tavoilla muiden molekyylien kanssa (dipoli-dipolo-vuorovaikutukset).
Esimerkkejä (kloori, happi, natrium, fluori)
Mitkä ovat kloorin, hapen, natrium- ja fluoriatomien elektronegatiivisuusarvot? Fluoridin jälkeen, joka on elektronegatiivisin? Määräaikaisen taulukon avulla havaitaan, että natriumilla on tumman violetti väri, kun taas hapenvärit ja kloori ovat visuaalisesti hyvin samanlaisia.
Heidän elektronegativiteettinsa arvot Paulingin, Mullikenin ja Allred-Rhow'n asteikkoihin ovat:
Na (0.93, 1.21, 1.01).
Tai (3.44, 3.22, 3.viisikymmentä).
Cl (3.16, 3.54, 2.83).
F (3.98, 4.43, 4.10).
Huomaa, että numeerisilla arvoilla on ero hapen ja kloorin negatiivisuuksien välillä.
Mulliken-asteikon mukaan kloori on elektronegatiivisempi kuin happi, toisin kuin Pauling- ja Allred-Rhochow-asteikot. Eleektronegatiivisuuden ero molempien elementtien välillä on vielä ilmeisempi käyttämällä Allred-Rhow-asteikkoa. Ja lopuksi, fluori on valituista asteikoista riippumatta elektronegatiivisimpi.
Siksi, jos molekyylissä on f -atomi, tarkoittaa, että linkillä on korkea ioninen merkki.
Viitteet
- Shiver & Atkins. (2008). Epäorgaaninen kemia. (Neljäs painos., p. 30 ja 44). MC Graw Hill.
- Jim Clark. (2000). Elektronegoniteetti. Otettu: Chemguide.yhteistyö.Yhdistynyt kuningaskunta
- Anne Marie Helmestine, PH.D -d. (11. joulukuuta 2017). Elektronegatiuden määritelmä ja esimerkki. Otettu: Admingco.com
- Merkki E. Tuckerman. (5. marraskuuta 2011). Elektronegatiteetti -asteikko. Otettu: NYU.Edu
- Wikipedia (2018). Elektronegatiivisuus. Otettu: se on.Wikipedia.org

