Aktivointienergia

- 4213
- 112
- Sheldon Kuhn
Selitämme, mikä on aktivointienergia, sen kaava, yksiköt, miten se lasketaan, ja annamme useita esimerkkejä
Mikä on aktivointienergia?
Se aktivointienergia (JA-lla) Se määritellään vähimmäisergiaksi, joka on tarpeen kemiallisen reaktion suorittamiseksi. Toisin sanoen, energiaeste on voitettava, jotta reagenssista voi tulla tuotteita.
Aktivointienergia voidaan nähdä toiminnassa jokapäiväisessä elämässä. Itse asiassa me kaikki tiedämme, että kun avaat kaasukäytävän keittiössä, se ei palaa heti, kun se on kosketuksessa ilman kanssa.
Joten palamisreaktio alkaa, on tarpeen antaa kipinä tai ottelun tuli. Tämä kipinä tai tämä tuli edustaa palamisreaktion aktivointienergiaa.
Miksi tarvitaan aktivointienergiaa?
Ymmärtääksesi syyn, miksi reaktiot tarvitsevat vähimmäisenergian esiintymistä, on ensisijaisesti ymmärtää, miten ne tapahtuvat. Kahden atomin tai molekyylin reagoimiseksi niiden on ensin törmättävä. Lisäksi heidän on tehtävä se oikealla suuntauksella, jotta voidaan muodostaa uusia kemiallisia sidoksia ja vanhat ihmiset voivat rikkoa.
Vaikka kaksi molekyyliä ohjataan toisiinsa täydellisellä suuntauksella, tämä ei varmista, että tehokas törmäys annetaan johtuen molekyylien pinnan elektronien välisestä torjunnasta.
Tästä syystä on välttämätöntä, että oikean suuntautumisen lisäksi molekyylit kulkevat myös jollain nopeudella tai jollain vähimmäis kineettisen energian avulla, joka varmistaa, että törmäys on riittävän vahva vastaamaan elektronien hylkäämistä.
Tämä mikroskooppisella tasolla tarvittava vähimmäiskineettinen energia on se, joka muuttuu reaktion aktivointienergiaksi.
Voi palvella sinua: litiumbromidi: rakenne, ominaisuudet, käytöt, riskitMitä näkyy energiakaaviossa?
Energiakaavio on graafinen esitys, joka osoittaa, kuinka reagenssien energia vaihtelee, kun ne muuttuvat tuotteiksi. Näissä kaavioissa, kuten alla esitetyssä kaavioissa, on helppo nähdä ja tulkita aktivointienergiaa.

Tässä kaaviossa sininen viiva näyttää energian reaktion edetessä. Täällä voit nähdä, että tuotteiksi tulemiseksi reagenssien on ensin voitettava mäki siirtymätilaan pääsemiseksi. Muuten heidät palautetaan alkuperäiseen tilaansa.
Tämän kukkulan korkeus on tarkasti aktivointienergia. Jos se on mahdollista voittaa, loput tie on alamäkeen, ja reagenssit päättyvät nopeasti tuotteiksi.
Aktivointienergiayksiköt
Aktivointienergia on intensiivinen suuruus, joka ilmaistaan energiayksiköissä massa- tai moolien yli. Koska energiayksiköitä ja erilaisia massayksiköitä on erilaisia, aktivointienergiaa voidaan ilmaista useissa eri yksiköissä. Kemiassa useimmiten käytetyt ovat:
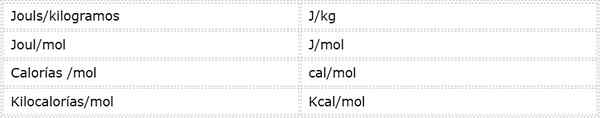
Mitä yksikköä käytetään, riippuu tietoista, joista se lasketaan, tai muissa laskelmissa annetusta käytöstä.
Aktivointienergiakaava
Aktivointienergia liittyy reaktionopeuteen. Itse asiassa mitä suurempi aktivointienergia, sitä pienempi nopeus. Tämä suhde ilmaistaan matemaattisesti Arrhenius -yhtälön kautta, joka liittyy lämpötilan reaktion nopeusvakion kautta.
Voi palvella sinua: Benedict Reagenssi: Mihin se on, komponentit, valmistelu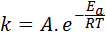
Tässä yhtälössä, k -k - Se on reaktion nopeusvakio ja-lla Se on aktivointienergia, r on ihanteellisten kaasujen vakio, t on absoluuttinen lämpötila ja sitä kutsutaan Arrhenius-esikäsittelykertoimeksi, jota kutsutaan myös törmäyskertoimeksi.
Tämä yhtälö voidaan järjestää uudelleen:
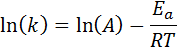
Jos reaktion A -arvo on tiedossa, aktivointienergia voidaan saada puhdistamalla edellinen yhtälö. Tämä ei kuitenkaan ole tapa, jolla reaktion aktivointienergia määritetään yleensä. Normaalisti nopeusvakio määritetään kahdessa tai useammassa lämpötilassa, mikä tekee siitä tarpeetonta tietää.
Kuinka aktivointienergia lasketaan?
Aktivointienergia määritetään nopeusvakion arvoista eri lämpötiloissa. Ainakin kaksi arvoa k -k - mitattu eri T -arvoilla aktivointienergian laskemiseksi tietämättä, mikä yleensä on.
Riippuen kuinka monta arvoa k -k - Heillä on, voit laskea ja-lla Kahdella tavalla:
1. Kun sinulla on k -k - kahdessa lämpötilassa
Näissä tapauksissa on helpompi aloittaa Arrhenius -yhtälön ensimmäisestä muodosta. Jos soitamme k -k -1 nopeusvakioon lämpötilassa T1 ja k -k -2 nopeusvakioon lämpötilassa T2, Sitten voimme kirjoittaa Arrhenius -yhtälön kahdesti:
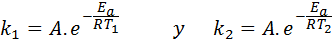
Nyt voimme jakaa minkä tahansa kahden yhtälön välisistä yhtälöistä peruuttaaksesi:
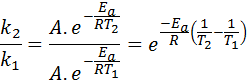
Sitten ottaen Neperian logaritmi molemmin puolin ja ratkaisee E-lla, on saatu:
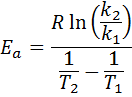
2. Kun sinulla on k -k - yli kaksi lämpötilaa
Tapauksissa, joissa nopeusvakiosta on useita määritelmiä eri lämpötiloissa, on edullista löytää aktivointienergia graafisesti tai lineaarisen regression avulla. Tämä perustuu logaritmisen muodon yhtälöön, jolla on linjan muoto:
Se voi palvella sinua: Clausius-Clapeyron yhtälö: Mihin se on, esimerkkejä, harjoituksia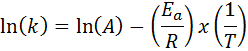
Jos teemme kaavion ln (k) verrattuna (1/t), saamme suoran viivan, joka leikkaa akselille ja LN (a): ssa ja jonka kaltevuus on yhtä suuri kuin -(E-lla/R). Sieltä aktivointienergia saadaan.
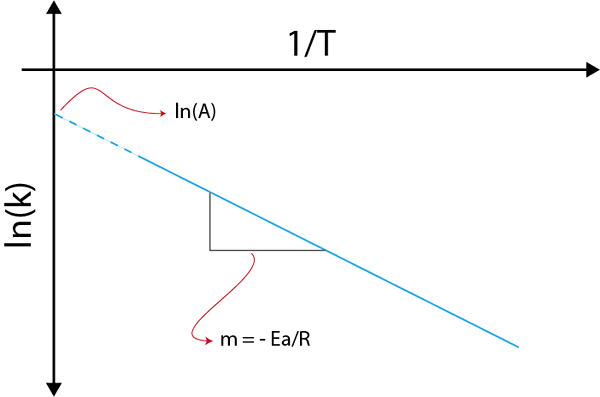 Arrhenius -kuvaaja aktivointienergian määrittämiseksi
Arrhenius -kuvaaja aktivointienergian määrittämiseksi Esimerkkejä aktivointienergioiden laskemisesta
Esimerkki 1
Ensimmäisen järjestyksen reaktion nopeusvakio määritettiin kahdessa eri lämpötilassa. 298 K: n arvo oli 0.058 s-1, kun taas 350 K: ssa arvo nousi 0,425 s-1. Määritä tämän reaktion aktivointienergia j/molissa.
- Ratkaisu: Koska sinulla on vakio kahdessa lämpötilassa, yllä esitettyä aktivointienergiakaavaa voidaan käyttää suoraan. Koska energiaa pyydetään J/MOL -yksiköissä, meidän on käytettävä kaasuvakiota näissä yksiköissä:
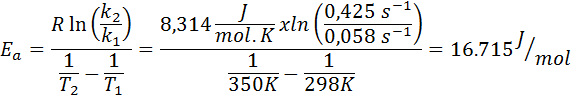
Esimerkki 2
Toisen asteen kemiallisen reaktion nopeusvakio mitataan eri lämpötiloissa. Arvot on esitetty seuraavassa taulukossa. Määritä aktivointienergia Kcal/molissa.
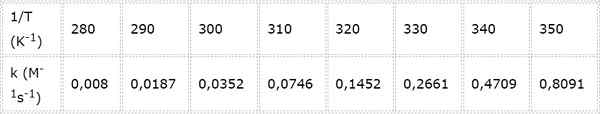
- Ratkaisu: Kuten tässä tapauksessa on useita lämpötiloja, on edullista määrittää aktivointienergia graafisesti. Tätä varten tehdään kaavio Ln (k) vs. 1/T, joka on esitetty alla.
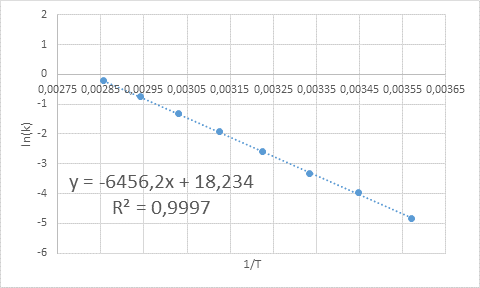 Esimerkki aktivointienergian graafisesta määrityksestä
Esimerkki aktivointienergian graafisesta määrityksestä Kaaviossa esitetyn viivan yhtälöstä kaltevuus saadaan, joka on -6456.2. Koska kaltevuus (m) on yhtä suuri kuin e-lla/R, sitten:
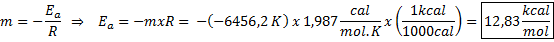
Eli tämän reaktion aktivointienergia on 12,83 kcal/mol.

