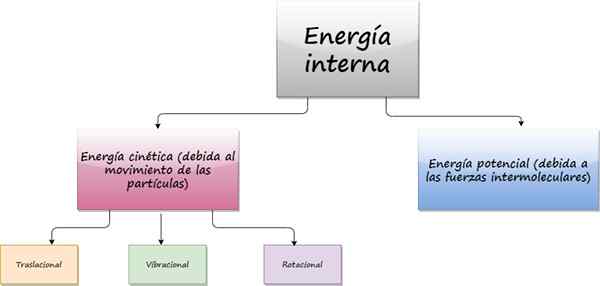
Sisäinen energia
- 1380
- 30
- Shawn Stanton II
Selitämme, mikä sisäinen energia on, sen toiminto, kuinka laskea se ja antaa useita esimerkkejä
 Kaavio, joka osoittaa panokset järjestelmän sisäiseen energiaan. Lähde: f. Zapata
Kaavio, joka osoittaa panokset järjestelmän sisäiseen energiaan. Lähde: f. Zapata Mikä on sisäistä energiaa?
Se sisäinen energia Esineestä tulee satunnaisliikkeestä, jotka sen muodostavat atomit ja molekyylit ovat. Jopa silloin, kun objekti on täydellisesti levossa, sisäpuolella, mikroskooppisella tasolla, hiukkaset liikkuvat jatkuvasti ilman lepoa.
Koska nämä hiukkaset liikkuvat, niillä on kineettinen energia, joka on osa heidän sisäistä energiaa. Toinen vaikutus sisäiseen energiaan on potentiaalinen energia, joka tulee molekyylien välisistä voimista, jotka vastaavat aineen koheesion ylläpitämisestä.
Nämä molekyylien väliset voimat ovat yleensä sähkömagneettista alkuperää, mutta myös gravitaatio- ja ydinvoimat osallistuvat.
Nyt, hiukkasten liikkumisen tyypistä riippuen, kineettinen energia voi olla:
- Translaatio-
- Värähtely-
- Kierto-
Lämpötila mittaa vain hiukkasten translaation kineettinen energia. Periaatteessa, suuremmassa lämpötilassa, sisäinen energia on suurempi, mutta tämä riippuu myös massasta. Eräs esimerkki Aihe selventää: Lasilla, jossa on lämmin vesi, on vähemmän sisäistä energiaa kuin järvellä huoneenlämpötilassa, vaikka lasin lämpötila on korkeampi, ja johtuu siitä, että järvessä on enemmän vettä kuin lasissa.
Joka tapauksessa aineen sisäinen energia ei ole havaittavissa, se ei riipu sen liikkeestä, eikä se ole riippuvainen suhteellisesta sijainnista muihin esineisiin nähden. Esimerkiksi lasin sisäinen energia, jolla on vettä huoneenlämpötilassa, on sama, jos lasi on pöydällä tai jos se on lattialla.
Voi palvella sinua: Ei -koplanarvektorit: Määritelmä, olosuhteet, harjoituksetSisäinen energiatoiminto
Sisäinen energia, joka on yleensä merkitty u: ksi, on funktio, joka riippuu järjestelmän termodynaamisista muuttujista, kuten lämpötila T ja tilavuus V. Siksi se voidaan ilmaista matemaattisesti seuraavasti:
U = u (t, v)
Todellisuudessa järjestelmän sisäisen energian absoluuttinen arvo ei ole merkitystä, tärkeätä on sen variaatio, joka on merkitty kreikkalaisella kirjaimella δ (“delta”):
ΔU = U alkukirjain - TAI lopullinen
Nyt sisäistä energiaa voidaan muuttaa, jos lämpöä lisätään tai uutetaan. Lämmön lisääminen On mahdollista, että järjestelmä tekee tietyn työn, kuten mäntä moottorin sylinterissä.
Termodynamiikan ensimmäinen laki
Termodynamiikan ensimmäisestä laista on vahvistettu Sisäisen energian vaihtelu Järjestelmästä, joka vastaa:
Δu = q - w
Jos järjestelmälle siirretyn lämmön määrä ja W on järjestelmä, jos se suorittaa joitain. Kaikki mitataan Joulesissa kansainvälisessä yksikköjärjestelmässä.
Jos järjestelmä ei toimi, toimitettua lämpöä käytetään kokonaisuudessaan järjestelmän sisäisen energian lisäämiseksi.
Seuraavat seuraavat edellisestä lausekkeesta:
- ΔU> 0 tarkoittaa, että järjestelmä lisää sisäistä energiaansa
- ΔU < 0 la energía interna del sistema disminuye
- Q> 0 Järjestelmä imee lämpöä
- W> 0 Järjestelmä toimii.
Kuinka laskea sisäinen energia?
Monoatominen ihanteellinen kaasu
Monoatomisessa ihanteellisessa kaasumallissa (yksi atomi) hiukkaset eivät ole vuorovaikutuksessa keskenään, joten translaatiokineettinen energia on ainoa vaikutus sisäiseen energiaan tai kaasuun. On lause, nimeltään Varustekause, joka toteaa, että jokaisella vapausasteella on energia, joka on yhtä suuri kuin:
Se voi palvella sinua: aaltodiffraktio: käsite ja esimerkitMissä t on lämpötila ja r on ihanteellisten kaasujen vakio, jonka arvo kansainvälisen järjestelmän yksiköissä on:
8.314472 J/mol ∙ K
Vapausaste edustaa mahdollisuutta liikkua koko avaruuden suuntaan. Ihanteellinen kaasuhiukkas voi liikkua avaruuden kolmeen suuntaan, joten kaasun N -moolien energia on:
Lämmön määrä
Olettaen, että järjestelmään lisätään lämpöä ja tämä ei toimi, tätä lämpöä käytetään vain järjestelmän sisäisen energian lisäämisessä. Lämmön määrä, jonka on oltava verrannollinen järjestelmän massa M ja lämpötilan muutos:
Q ∝ m⋅δt
Suhteellisuusvakio riippuu aineesta ja sitä kutsutaan erityinen lämpö. Soittaen C tähän vakioon, lämpö on:
Q = mc⋅δt
Kun lämpöä käännetään lisäämään sisäistä energiaa:
Q = mc⋅δt = ΔU
ΔU vastaa vaihtelu Sisäisessä energiassa.
Esimerkkejä sisäisestä energiasta
1. Lämpötilan vaihtelut
Aineiden lämpötilan muutokset puolestaan aiheuttavat muutoksia niiden sisäisessä energiassa. Näin tapahtuu esimerkiksi ruoanlaitossa. Kuumentamalla ruokaa sen molekyylien levottomuus kasvaa, kineettinen energia kasvaa ja tekee siksi sisäisen energiansa.
2. Kahden aineen sisäinen energia samassa lämpötilassa
Kahdella samassa lämpötilassa olevalla aineella ei välttämättä ole samaa sisäistä energiaa, koska se riippuu kahdesta vaikutuksesta: kineettinen energia ja potentiaalienergia.
Jos aineet ovat samassa lämpötilassa, voidaan vahvistaa, että sen hiukkasten translaatiokineettinen energia on sama, mutta potentiaalinen energia on erilainen, koska tämä riippuu aineosan atomien kokoonpanosta.
Voi palvella sinua: hydrostaattinen paine: kaava, laskenta, esimerkit, harjoitukset3. Lämpölaajeneminen
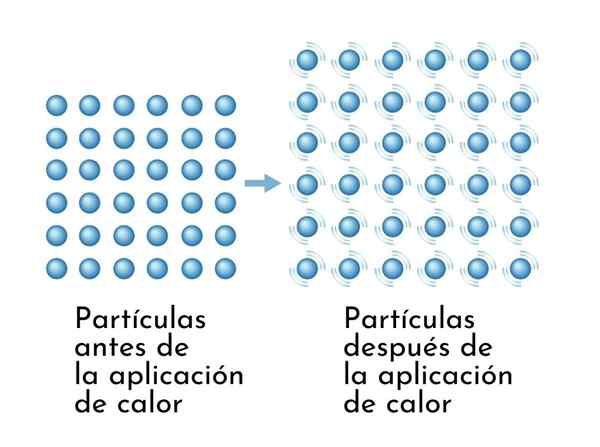 Aineet laajenevat lämmitettäessä, koska sisäisen energian lisääntyminen aiheuttaa niiden hiukkasten värähtelyn laajemmin, joten mitat kasvavat
Aineet laajenevat lämmitettäessä, koska sisäisen energian lisääntyminen aiheuttaa niiden hiukkasten värähtelyn laajemmin, joten mitat kasvavat Lämmitysaineiden näkyvä seuraus on niiden mittojen lisääntyminen, koska sen atomien välinen keskimääräinen etäisyys kasvaa.
Molekyylien välisiä voimia voidaan simuloida atomin yhdistävien lähteiden kautta.
4. Pakatut kaasut
Paine kaasut voivat varastoida sisäistä energiaa, koska niiden tiheys kasvaa vähentämällä tilavuutta ja sen kanssa sen vuorovaikutukset säiliön seinämien kanssa. Tällä tavoin pakattu kaasu pystyy tekemään työn, kuten männän siirtäminen.
5. Paristot
Akkujen kemiallisissa reaktioissa esiintyy sähkövirran tuottaminen heti, kun piiri sulkeutuu. Tätä kemiallista potentiaalienergiaa pidetään osana järjestelmän sisäistä energiaa.
6. Järjestelmä, joka imee lämpöä ja toimii
Kun järjestelmä imee lämpöä, se lisää sen sisäistä energiaa. Mutta jos hän tekee samalla työtä, ensimmäistä termodynamiikan lakia voidaan käyttää tietämään, kuinka paljon sisäistä energiaa muuttuu. Esimerkiksi olettaen, että järjestelmä absorboi 175 J: n lämpöä ja suorittaa 62 J: n työpaikkaa, sen sisäisen energian muutos on:
ΔU = Q - W = 175 J - 62 J = 113 J.



