Koordinoitu kovalenttisidos
- 1627
- 369
- Kelly Kilback
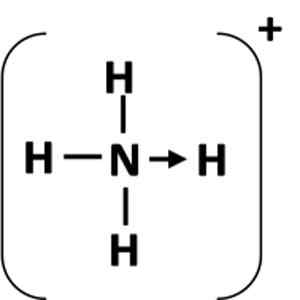
 Kuva 1: Koordinaatioyhteyden esitys antajan (n) atomin ja vastaanottajan (H) välillä.
Kuva 1: Koordinaatioyhteyden esitys antajan (n) atomin ja vastaanottajan (H) välillä. Mikä on koordinoitu kovalenttinen linkki?
Eräs koordinoitu kovalenttisidos, tai koordinointiyhteys, onTyyppinen linkki, jossa yksi atomeista toimittaa kaikki jaetut elektronit. Sitä kutsutaan myös datiivi- tai bipolaariseksi linkille.
Yksinkertaisessa kovalenttisessa linkissä jokainen atomi toimittaa elektronin linkkiin. Toisaalta koordinaatiolinkissä yksi atomi lahjoittaa elektronit linkin muodostamiseksi, ja sitä kutsutaan antaja -atomiksi, kun taas atomia, joka hyväksyy elektroniparit liittyäkseen.
Koordinaatiolinkkiä edustaa nuoli, joka alkaa antamisatomista ja päättyy vastaanottaja -atomiin (kuva 1). Joissakin tapauksissa luovuttaja voi olla molekyyli.
Tässä tapauksessa molekyylin atomi voi luovuttaa elektroniparin, joka olisi Lewisin pohja, kun taas hyväksynnän kapasiteetin molekyyli olisi Lewis -happo.
Koordinaatiolinkillä on samanlaiset ominaisuudet kuin yksinkertaisen kovalenttisen sidoksen ominaisuudet. Yhdisteillä, joilla on tämän tyyppinen linkki.
Joitakin esimerkkejä koordinoiduista kovalenttilinkeistä
Yleisin esimerkki koordinaatiolinkistä on ammoniumioni, joka muodostuu ammoniakkimolekyylin ja hapon protonin yhdistelmällä.
Voi palvella sinua: Kemiallinen yhtälö: Osat ja esimerkitAmmoniakkiin typpiatomilla on yksinäinen elektronipari sen jälkeen, kun se on valmistunut oktetiksi. Tehty tämä yksinäinen pari vety -ionille, joten typpiatomista tulee luovuttaja. Vetyatomista tulee vastaanottaja.
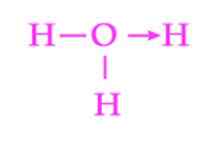 Kuva 2: Hydronio -ionin koordinaatiolinkin esitys
Kuva 2: Hydronio -ionin koordinaatiolinkin esitys Toinen yleinen esimerkki datiivisesta yhteydestä on hydroniumionin muodostuminen. Kuten ammoniumioni, myös vesimolekyylin vapaiden elektronien pari toimii antajana protonille, joka on vastaanottaja (kuva 2).
On kuitenkin pidettävä mielessä, että kun koordinaatioyhteys on muodostettu, kaikki happea kiinnitetyt vedyt ovat tarkalleen vastaavia. Kun vety -ioni rikkoutuu uudelleen, ei ole syrjintää, minkä hydrogeneista vapautuu.
Erinomainen esimerkki happopohjaisesta happareaktiosta, joka kuvaa koordinoituneen kovalenttisidoksen muodostumista, on booritrifluoridiadduktion muodostumisreaktio ammoniakin kanssa.
Boro -trifluoridi on yhdiste, jolla ei ole jaloa kaasurakennetta boro -atomin ympärillä. Boorin valenssikerroksessa on vain 3 paria elektronia, joten sanotaan, että BF3 on puutteellinen elektroneissa.
Ammoniakin typen typpimomentti voidaan käyttää tämän puutteen voittamiseen, ja muodostuu yhdiste, joka tarkoittaa koordinaatiolinkkiä.
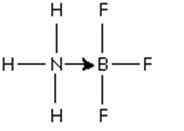 Kuva 3: Addukti boorin trifluoridimolekyylin ja ammoniakin välillä
Kuva 3: Addukti boorin trifluoridimolekyylin ja ammoniakin välillä Että typpielektronien pari luovutetaan boorin tyhjään kiertoradalle. Tässä ammoniakki on Lewisin ja BF3: n perusta Lewisin happo.
Voi palvella sinua: typen valenssitKoordinointikemia
Siirtymämetallien muodostavien yhdisteiden tutkimukseen on omistettu epäorgaanisen kemian haara. Nämä metallit sitoutuvat muihin atomiin tai molekyyleihin koordinaatioyhteyksillä muodostaen monimutkaisia molekyylejä.
Nämä molekyylit tunnetaan koordinointiyhdisteinä ja niitä tutkittavana tieteenä kutsutaan koordinaatiokemiaksi.
Tässä tapauksessa metalliin kytketty aine, joka olisi elektronin antaja, tunnetaan ligatointina ja yleisesti koordinaatioyhdisteille tunnetaan komplekseina.
Koordinointiyhdisteet sisältävät aineet, kuten B12 -vitamiini, hemoglobiini ja klorofylli, väriaineet ja pigmentit sekä orgaanisten aineiden valmistuksessa käytetyt katalyyttit.
Esimerkki kompleksista ionista olisi kobolttikompleksi [CO (NH2CH2CH2Nh2) 2clnh3-2+ Se olisi diklooriaaminethhylandiamin Cobalt (IV).
Koordinointikemia syntyi Alfred Wernerin työstä, sveitsiläisestä kemististä, joka tutki erilaisia kobolttikloridiyhdisteitä (III) ja ammoniacia. Kloorivetyhapon lisäämisen jälkeen Werner havaitsi, että ammoniakkia ei voitu eliminoida kokonaan. Sitten hän ehdotti, että ammoniakki olisi liitettävä läheisemmin koboltti -ioniin.
Kuitenkin, kun vesipitoista hopea -nitraattia lisättiin, yksi muodostuneista tuotteista oli kiinteä hopeakloridi. Muodostuneen hopeakloridin määrä liittyi ammoniakkimolekyylien lukumäärään, joka on kytketty kobolttikloridiin (III).
Esimerkiksi, kun hopea -nitraatti lisättiin COCL: ään3 · 6NH3, Kolmesta kloridista tuli hopeakloridi.
Kuitenkin kun hopea -nitraatti lisättiin COCL: ään3 · 5nh3, Vain 2 kolmesta kloridista muodosti hopeakloridin. Kun se oli cocl3.4NH3 Hopea -nitraatilla yksi kolmesta kloridista saostettiin hopeakloridiksi.
Se voi palvella sinua: Píchricihappo: Mikä on, rakenne, synteesi, ominaisuudetTuloksena olevat havainnot ehdottivat monimutkaisten yhdisteiden muodostumista tai koordinaatiota. Sisäisessä koordinointipallassa, jota kutsutaan myös joissakin teksteissä ensimmäisenä pallona, ligandit yhdistyvät suoraan keskusmetalliin.
Ulkoisessa koordinaatiopallossa, jota joskus kutsutaan toiseksi palloksi, muut ionit kiinnitetään kompleksin ioniin. Werner sai Nobel -palkinnon vuonna 1913 hänen koordinaatioteoriastaan.
Tämä koordinaatioteoria aiheuttaa siirtymämetallien olevan kahden tyyppisiä Valencia: ensimmäisellä Valencialla, joka määritetään metallin hapettumisnumerolla, ja toista Valencia -nimistä koordinaationumeroa.
Hapetusnumero kertoo, kuinka monta kovalenttista sidosta voidaan muodostaa metalliksi (esimerkki, rauta (II) tuottaa rumaa) ja koordinaationumero kertoo kuinka monta koordinaatiolinkkiä voidaan muodostaa kompleksissa (esimerkki, rauta koordinaationumerolla 4 [FECL4-- ja [FECL4-2--A.
Koboltin tapauksessa siinä on koordinaationumero 6. Siksi Wernerin kokeissa, lisäämällä hopea -nitraatin, hopeakloridin määrä, joka jätti heksakoordinoituneen koboltin.
Tämän tyyppisten yhdisteiden koordinaatioyhteyksillä on ominaisuus värilliselle.
Itse asiassa ne ovat vastuussa metalliin liittyvästä tyypillisestä väristä (punainen rauta, sininen koboltti jne.) ja ovat tärkeitä absorptio- ja atomiemissioiden spektrofotometrisille harjoituksille.
Viitteet
- Kemiallinen sidos. Toipunut Britannicasta.com.
- Koordinoi kovalenttisidos (S.F.-A. Kemiasta palautettu.Ohjaaja.

