Kaksinkertainen kovalenttinen sidos

- 4203
- 451
- Dr. Travis Reichert
Selitämme, mikä on kaksinkertainen kovalenttinen sidos, sen ominaisuudet ja annamme useita esimerkkejä
 Eteno- tai etyleenimolekyyli. Se on tyypillinen esimerkki kaksoiskovalentista sidoksesta kahden hiiliatomin välillä
Eteno- tai etyleenimolekyyli. Se on tyypillinen esimerkki kaksoiskovalentista sidoksesta kahden hiiliatomin välillä Mikä on kaksinkertainen kovalenttinen sidos?
Se kaksinkertainen kovalenttiset sidokset Ne ovat kemiallisia linkkejä, joissa kahdella atomilla on kaksi paria elektroneja. Toisin sanoen, ne ovat kovalenttisia sidoksia, jotka muodostavat yhteensä neljä valenssielektronia, jotka pyörivät kahden atomin ympärillä.
Kaksinkertaiset linkit ovat hyvin yleisiä orgaanisissa yhdisteissä. Esimerkiksi kaikilla alkeeneilla on kaksoishiilihiili-sidos. Monilla muilla funktionaalisilla ryhmillä, kuten aldehydeillä, ketoneilla, karboksyylihapolla ja amideilla, on myös kaksoiskovalenttisia sidoksia hiilen ja hapen välillä. Muilla, kuten imiinillä, on kaksinkertainen kovalenttiset sidokset c = n.
Kaksinkertaisilla linkillä on monia ominaisuuksia, jotka erottavat ne muun tyyppisistä kovalenttisista sidoksista, kuten yksinkertaiset linkit ja kolminkertaiset linkit. Ne eroavat niistä sisältävien molekyylien muodossa, pituuden ja yhdistämisvoiman ja muiden kemiallisten ominaisuuksien ominaisuuksien suhteen.
Kaksinkertainen kovalenttiset linkkiominaisuudet
Ne muodostuvat 4 elektronia
Syy siihen, miksi kaksoissidokset ovat, koska ne sisältävät kaksinkertaisen elektronien yksinkertaisen kovalenttisen sidoksen, joka muodostuu, kun kahdella atomilla on kaksi valenssielektronia. Tämä tarkoittaa, että jokainen kaksoissidos sisältää 4 elektronia.
Ne muodostetaan sigma -linkillä (σ) ja pi (π) -linkillä
Niistä neljästä elektronista, jotka muodostavat kaksoissidoksen, heistä 2 on menossa ja tulee yhden atomin väliin, kulkee kahden keskustan läpi. Tätä elektroniparia kutsutaan Sigma -elektroniksi, koska ne muodostavat sigma -sidoksen (σ).
Toinen elektronipari kelluu kahden atomin ylä- ja alapuolella, mikä tekee eräänlaisen voileivän. Näitä elektroneja kutsutaan PI -elektroniksi ja muodostavat pi (π) -linkin.
Voi palvella sinua: kloorobentseeni (C6H5CL)Yhdessä Sigma -linkki ja PI -linkki muodostavat kaksinkertaisen kovalenttisen sidoksen.
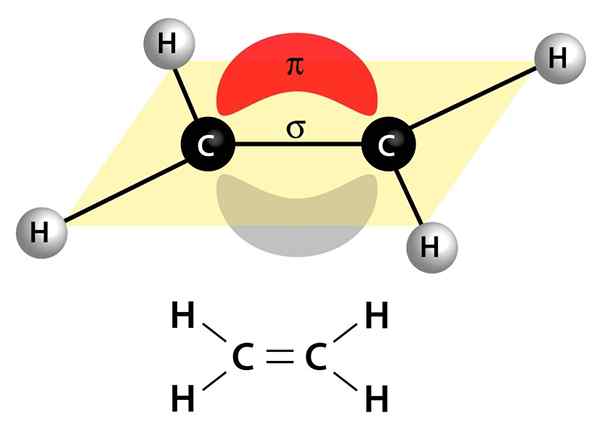 Tämä kuva näyttää kaksi linkkiä, jotka muodostavat kaksoissidoksen: PI -linkki, joka näkyy punaisena ja harmaana pilvinä, joka on molekyylin ylä- ja alla, ja sigma -linkki, joka on linja, joka yhdistää molemmat ytimet keskuksen läpi
Tämä kuva näyttää kaksi linkkiä, jotka muodostavat kaksoissidoksen: PI -linkki, joka näkyy punaisena ja harmaana pilvinä, joka on molekyylin ylä- ja alla, ja sigma -linkki, joka on linja, joka yhdistää molemmat ytimet keskuksen läpi Ne voivat olla polaarisia tai apolaarisia
Atomien elektronegatiivisuudesta riippuen, jotka yhdistyvät kaksoiskovalenttisen sidoksen avulla, se voi olla polaarinen tai apolaarinen.
Esimerkiksi kaksinkertainen kovalenttinen sidos C = c Se on apolaarinen linkki, koska molemmat atomit ovat samat ja niillä on sama elektronegatiivisuus. Sen sijaan kaksinkertainen kovalenttinen sidos C = O Se on polaarista, koska happi on paljon elektronegatiivisempaa kuin hiili.
Ne ovat vahvempia kuin yksinkertaiset linkit
Kaksinkertaisen sidoksen rikkominen on vaikeampaa kuin yksinkertaisen linkin rikkominen samojen kahden atomin välillä. Tämä johtuu siitä, että kaksoissidoksen katkaiseminen sekä Sigma -linkki (joka on yhtä suuri kuin yksinkertainen linkki) että PI -linkki on rikki. Koska kaksi linkkiä on rikki yhden sijasta, kaksoissidos on vahvempi kuin yksinkertainen.
Ne ovat heikompia kuin kolminkertaiset linkit
Kolminkertaiseen linkkiin verrattuna kaksoissidos on heikompi ja helpompi rikkoa. Syynä on sama kuin ennen, vain siinä tapauksessa kaksoissidoksella on vähemmän linkkejä kuin rikkoutumisella verrattuna kolminkertaiseen linkkiin.
Ne ovat lyhyempiä kuin yksinkertaiset linkit
Vahvemmat linkit kuin yksinkertaiset linkit, kaksoissidokset pystyvät tuomaan linkitettyjä atomeja lähemmäksi kuin yksinkertaiset linkit kuin yksinkertaiset linkit. Tästä syystä, jos kaksois C = C-linkkiä verrataan yksinkertaiseen C-C-linkkiin, ensimmäinen on aina lyhyempi kuin toinen.
Voi palvella sinua: Natriumtiosulfaatti (Na2S2O3)Ne ovat pidempiä kuin kolminkertaiset linkit
Jälleen, kun kolminkertainen linkki on vahvempi kuin kaksoislinkki, kolminkertainen linkki on lyhyempi. Tämä tarkoittaa, että kaksinkertaiset kovalenttiset sidokset ovat pidempiä kuin kolminkertainen.
Ne ovat jäykkiä linkkejä.
Yksinkertaiset kovalenttiset sidokset ovat melko joustavia ja voivat myös pyöriä. Toisaalta kaksoissidokset ovat jäykkiä, ne eivät ole joustavia eikä niitä voida kiertää, koska edellä mainittu PI -linkki rikkoutuu.
Ne edustavat tyydyttymättömyyttä
Molekyylissä, jolla on kaksoissidos, on kaksi vähemmän kytkettyä vetyatomia. Tästä syystä sanotaan.
Ne muodostavat litteä kolmion muotoisia molekyylejä
Hiiliatomi, joka muodostaa kaksinkertaisen kovalenttisen sidoksen ja kaksi muuta yksinkertaista sidosta, muodostaa aina tasaisen molekyylin, jossa kolme sidosta osoittavat kolmion päihin. Tätä muotoa kutsutaan tasaiseksi trigonaaliseksi geometriaksi.
Esimerkkejä kaksoiskovalentista sidoksista
Linkki C = c etyleenissä
Etyleeni on yksi yksinkertaisimmista esimerkeistä kaksoiskovalenttisesta sidoksesta, tässä tapauksessa kahden hiiliatomin välillä.
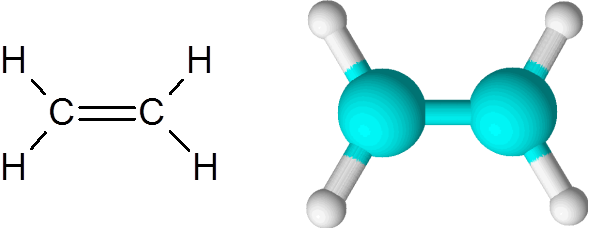 Etyleenimolekyyli
Etyleenimolekyyli Molekyyli on täysin tasainen, eikä linkkiä ole mahdollista kiertää mihinkään suuntaan. Tämä kaksoissidos on täysin apolaarinen, koska se yhdistää kaksi yhtä suurta atomia.
Linkki c = O asetonissa
Kaikki ketonit sisältävät karbonyyliryhmän, joka koostuu hiiliatomista ja happiatomista, joka on yhdistynyt kaksinkertaisen kovalenttisen sidoksen avulla.
Voi palvella sinua: Mikä on kemiallinen kinetiikka?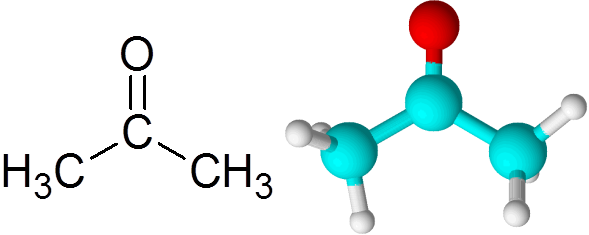 Asetonimolekyyli
Asetonimolekyyli Jokainen atomi antaa kaksi puuttuvaa elektronia sekä PI- että Sigma -linkin muodostamiseksi, jotka muodostavat kaksoissidoksen. Suurin osa ketoneista esiintyvistä kemiallisista reaktioista johtuu kaksoissidoksesta C = O.
Linkki o = tai otsonimolekyylissä (tai3-A
Tässä tapauksessa keskushappiatomi on kytketty kahteen muuhun happiatomiin. Yksi kahdesta sidoksesta muodostuu 4 elektronia, joten se vastaa kaksinkertaista kovalenttista sidosta. Kolme atomia ja pari elektronia ilman jakamista, joilla on keskimmäinen happiatomi, ovat kaikki samassa näytön tasossa, jotka osoittavat kolmion kulmiin.
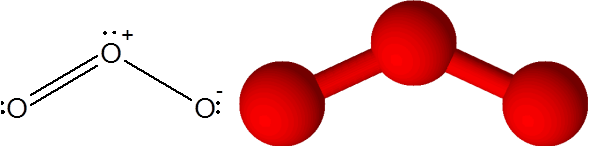 Otsonimolekyyli
Otsonimolekyyli Otsonilla on erityispiirteet, että kaksoissidos voi "hypätä" yhdestä päätelappista toiseen. Itse asiassa hän tekee sen hyvin nopeasti resonanssin nimisen prosessin kautta.
C = c linkit butadienoon (c4H6-A
Butadieno on esimerkki orgaanisesta yhdisteestä, jolla on kaksi kaksinkertaista kovalenttisia sidoksia c = c.
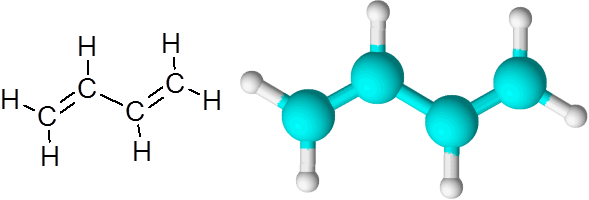 1,3-butadieenimolekyyli
1,3-butadieenimolekyyli Kun kaksoissidokset ovat tällä tavalla, erotettuna yhdellä yksinkertaisella linkillä, sanotaan, että ne ovat konjugoituja kaksoislinkkejä.

