Ionilinkin ominaisuudet, miten muodot ja esimerkit

- 1396
- 383
- Ronald Reilly
Hän ioniyhteys Se on eräänlainen kemiallinen sidos, jossa ionien välillä on sähköstaattinen vetovoima vastakkaisella kuormalla. Toisin sanoen positiivisesti kuormitettu ioni muodostaa yhteyden negatiivisesti ladattuun ioniin, siirtämällä elektroneja atomista toiseen.
Tämän tyyppinen kemiallinen sidos tapahtuu, kun yhden atomin valenssielektronit siirretään pysyvästi toiseen. Elektroneja menettää atomi tulee kationiksi (positiivisesti ladattu), ja elektroneista saavasta anionista (negatiivisesti ladattu).
 Ionisidos Esimerkki: Natriumfluori. Natrium menettää Valencia -elektronin ja antaa sen fluorialle. Wdcf [cc by-s (https: // creativecommons.Org/lisenssit/by-SA/3.0)]
Ionisidos Esimerkki: Natriumfluori. Natrium menettää Valencia -elektronin ja antaa sen fluorialle. Wdcf [cc by-s (https: // creativecommons.Org/lisenssit/by-SA/3.0)] [TOC]
Ioni -linkkikonsepti
Ionisidos on se, jolla sähköisesti varautuneet hiukkaset, joita kutsutaan ioneiksi, ovat vuorovaikutuksessa ionisten kiinteiden aineiden ja nesteiden aiheuttamiseksi. Tämä linkki on satojen miljoonien ionien välisten sähköstaattisten vuorovaikutusten tuote, eikä se rajoitettu vain pariin niistä; Eli se ylittää vetovoiman positiivisen taakan välillä negatiiviseen kuormaan.
Harkitse esimerkiksi ionista yhdistettä natriumkloridia, NaCl, joka tunnetaan parhaiten nimellä Pöytäsuola. NaCl: ssä ioninen sidos hallitsee, joten se koostuu Na -ioneista+ ja cl-. Sitten eräs+ Se on positiivinen ioni tai kationi, kun taas Cl- (Kloridi) on negatiivinen ioni tai anioni.
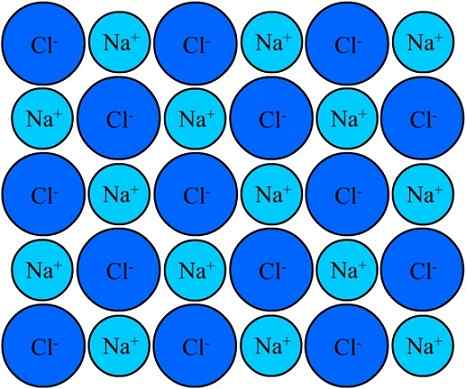 Natriumkloridin Na+ ja Cl-ionit pysyvät yhtenäisinä ionisen sidoksen ansiosta. Lähde: Eyal Bairey Wikipedian kautta.
Natriumkloridin Na+ ja Cl-ionit pysyvät yhtenäisinä ionisen sidoksen ansiosta. Lähde: Eyal Bairey Wikipedian kautta. Molemmat NA+ Kuten Cl- Heitä houkutellaan vastakkaisiin sähkömaksuihin. Näiden ionien väliset etäisyydet antavat muiden lähestyä, niin että NaCl -parit ja -parit ilmestyvät. Kationit+ He hylkäävät keskenään yhtä suuret kuormat, ja sama tapahtuu keskenään CL -anionien kanssa-.
Tulee aika, jolloin miljoonat Na -ionit+ ja cl- Ne onnistuvat yhdistämään, yhtenäisesti, perustamaan rakenteen mahdollisimman vakaana; Ioninen linkki (ylivoimainen kuva) hallitsee. Kationit+ Ne ovat pienempiä kuin cl -anionit- Sen ytimen kasvavan tehokkaan ydinvoiman vuoksi ulkoisissa elektroneissa.
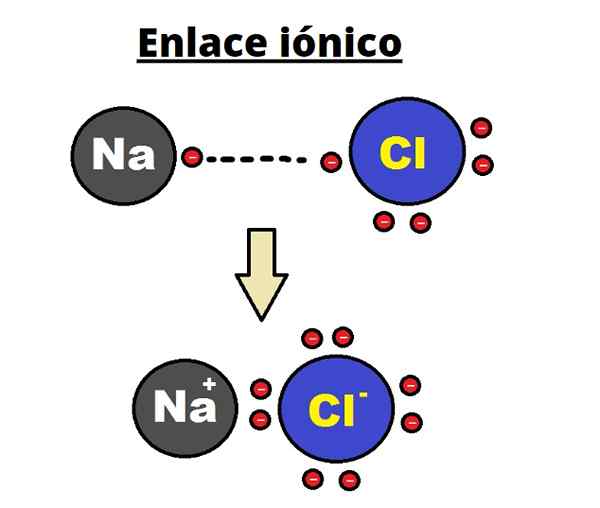 NaCl -ioninen linkki. Rhannosh/CC BY-SA (https: // creativecommons.Org/lisenssit/by-SA/3.0)
NaCl -ioninen linkki. Rhannosh/CC BY-SA (https: // creativecommons.Org/lisenssit/by-SA/3.0) Ionisidokselle on ominaista määrittämällä tilatut rakenteet, joilla ionien välinen etäisyys (NA+ ja cl- NaCl: n tapauksessa) se on pieni verrattuna muiden kiinteiden aineiden tapaan. Ionisesta kiteisestä rakenteesta puhuu.
Kuinka ioninen linkki on?
Ionisidos tapahtuu vain, jos elektronien jakauma tapahtuu siten, että ionikuormitukset syntyvät. Tämän tyyppistä linkkiä ei voi koskaan tapahtua neutraalien hiukkasten välillä. Kationeja ja anioneja on välttämättä oltava. Mutta mistä he tulevat?
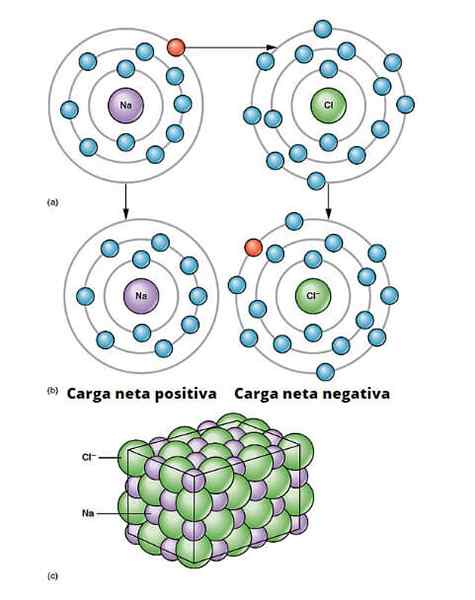 Ioninen linkkikuva. a) Natriumilla on negatiivinen nettokuorma. b) Natrium antaa elektronin klooriin. Natrium on positiivisella nettokuormituksella ja kloorilla, jolla on negatiivinen nettokuorma, tuottaen ionisidoksen. Tämäntyyppinen yhteys miljoonien NA- ja CL -atomien välillä aiheuttaa fyysistä suolaa. OpenX College/CC by (https: // creativecommons.Org/lisenssit/by/3.0)
Ioninen linkkikuva. a) Natriumilla on negatiivinen nettokuorma. b) Natrium antaa elektronin klooriin. Natrium on positiivisella nettokuormituksella ja kloorilla, jolla on negatiivinen nettokuorma, tuottaen ionisidoksen. Tämäntyyppinen yhteys miljoonien NA- ja CL -atomien välillä aiheuttaa fyysistä suolaa. OpenX College/CC by (https: // creativecommons.Org/lisenssit/by/3.0) On olemassa monia tapoja, joilla ionit ovat peräisin, mutta pohjimmiltaan monet perustuvat hapettumisen vähentämisreaktioon. Suurin osa epäorgaanisista ioniyhdisteistä koostuu metallisesta elementistä, jolla on ei -metallinen elementti (lohkon yhdisteet p jaksollisesta taulukosta).
Metallin on hapettua, kadotettava elektronit muuttumaan kationiksi. Toisaalta ei -metallinen elementti vähenee, saa nämä elektronit ja siitä tulee anioni. Seuraava kuva kuvaa tätä pistettä NaCl: n muodostumiselle natrium- ja klooriatomeista:
Voi palvella sinua: arseenihappo (H3SO4): Ominaisuudet, riskit ja käytöt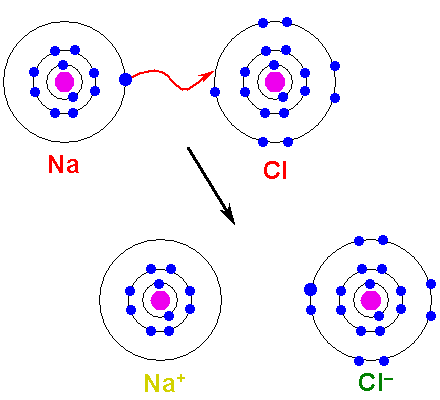 Ionisen linkin muodostuminen. Lähde: Shafei arabialaisessa Wikipediassa / julkisessa alueessa
Ionisen linkin muodostuminen. Lähde: Shafei arabialaisessa Wikipediassa / julkisessa alueessa NA -atomi lahjoittaa yhden valencia -elektroneista CL: lle. Kun tämä elektronijakauma tapahtuu, muodostuu Na -ionit+ ja cl-, jotka alkavat houkutella välittömästi ja sähköisesti.
Siksi sanotaan, että na+ ja cl- He eivät jaa mitään elektroniparia, toisin kuin mitä voidaan odottaa hypoteettiselle Na-Cl-kovalenttiselle sidolle.
Ionilinkin ominaisuudet
Ioninen sidos ei ole suuntautuvaa, ts. Sen lujuutta ei ole läsnä yhteen suuntaan, vaan sitä leviää avaruudessa, joka perustuu etäisyyksiin, jotka erottavat ionit. Tämä tosiasia on tärkeä, koska se tarkoittaa, että ionit ovat voimakkaasti yhtenäisiä, mikä selittää useita ionisten kiinteiden aineiden fysikaalisia ominaisuuksia.
Sulamispiste
Ionisidos on vastuussa suolasta lämpötilaan 801 ºC. Tämä lämpötila on huomattavasti korkea verrattuna useiden metallien fuusiopisteisiin.
Tämä johtuu siitä, että NaCl on absorboida tarpeeksi lämpöä, jotta sen ionit alkavat virtata vapaasti kiteidensä ulkopuolella; ts. NA: n väliset nähtävyydet on voitettava+ ja cl-.
Kiehumispiste
Ionisten yhdisteiden fuusio- ja kiehumispisteet ovat erityisen korkeat tuotteet niiden vahvoista sähköstaattisista vuorovaikutuksista: niiden ioninen sidos. Koska tämä linkki liittyy kuitenkin monia ioneja, tämä käyttäytyminen myönnetään yleensä molekyylien välisille voimille, eikä ionisidolle kunnolla.
Suolan tapauksessa, kun NaCl on sulanut, saadaan samoista alkuperäisistä ioneista koostuva neste; Vasta nyt he liikkuvat suuremman vapauden kanssa. Ionilinkki on edelleen läsnä. Na -ionit+ ja cl- Ne kokoontuvat nesteen pinnalla luodakseen suuren pintajännityksen, mikä estää ioneja pääsemästä kaasufaasiin.
Siksi sulan suolan on edelleen nostettava lämpötilansa kiehua. NaCl: n kiehumispiste on 1465 ºC. Tässä lämpötilassa lämpö ylittää NA: n väliset nähtävyydet+ ja cl- Nesteessä NaCl -höyryt alkavat muodostua paineessa, joka on yhtä suuri kuin ilmakehän.
Elektronegatiivisuus
Aikaisemmin sanottiin, että ioninen sidos muodostuu metallisen elementin ja ei -metallisen elementin välillä. Yhteenvetotilit: metallin ja ei -metallin välillä. Tavallisesti tämä on epäorgaanisten ionisten yhdisteiden suhteen; Ennen kaikkea binaarityyppiset, kuten NaCl.
Elektronien jakautumiselle (NA+Cl-) Eikä jakamista (Na-Cl), molempien atomien välillä on oltava suuri elektronegatiivisuusero. Muuten niiden välillä ei olisi ionista yhteyttä. Mahdollisesti NA- ja CL -lähestymistapa, vuorovaikutuksessa, mutta heti CL, sen suuremman elektronegatiivisuuden vuoksi "nappaa" elektronia NA: hon.
Tämä skenaario koskee kuitenkin vain binaarisia yhdisteitä, MX, kuten NaCl. Muiden suolojen tai ionisten yhdisteiden kohdalla niiden harjoitusprosessit ovat monimutkaisempia, eikä niitä voida käsitellä pelkästään atomi- tai molekyylin näkökulmasta.
Se voi palvella sinua: AlquinosKaverit
Ionisia sidoksia ei ole erityyppisiä, koska sähköstaattinen ilmiö on puhtaasti fyysistä, vaihtelee vain tapaa, jolla ionit ovat vuorovaikutuksessa, tai niiden atomien lukumäärää; Eli jos ne ovat monotomia- tai polyiatomisia ioneja. Jokainen elementti tai yhdiste aiheuttaa myös ominaisen ionin, joka määrittelee yhdisteen luonteen.
Esimerkkien osassa tämä kohta syvenee, ja nähdään, että ioninen linkki on sama pohjimmiltaan kaikissa yhdisteissä. Kun tätä ei täytetä, sanotaan, että ionisidoksella on tietty kovalenttinen luonne, joka on monien siirtymämetallien tapaus, jossa anionit koordinoivat kationien kanssa; Esimerkiksi FECL3 (Usko3+-Cl--A.
Esimerkkejä ionisista linkeistä
Alla luetellaan useita ionisia yhdisteitä, ja niiden ionit ja mittasuhteet korostetaan:
- Magnesiumkloridi
Mgcl2, (Mg2+Cl-), 1: 2 -suhteessa (mg2+: 2 Cl--A
- Kaliumfluori
KF, (k+F-), 1: 1 -suhteessa (k+: F--A
- Natriumsulfidi
Naa2S, (na+S2-), Osuudessa 2: 1 (toinen+S2--A
- Lito -hydroksidi
Lioh (li+vai niin-), 1: 1 -suhteessa (Li+: Vai niin--A
- Kalsiumfluori
Kahvila2, (AC2+F-), 1: 2 -suhteessa (CA2+: 2F--A
- Sooda
Naa2Yhteistyö3, (NA+Yhteistyö32-), Osuudessa 2: 1 (toinen+: Co32--A
- Kalsiumkarbonaatti
Varas3, (AC2+Yhteistyö32-), 1: 1 -suhteessa (CA2+: Co32--A
- Kaliumpermanganaattia
Kmno4, (K+Mne4-), 1: 1 -suhteessa (k+: MN4--A
- Kuparisulfaatti
Cuso4, (Cu2+Sw42-), 1: 1 -suhteessa (Cu2+Niin42--A
- Bariumhydroksidi
Ba (OH)2, (BA2+vai niin-), 1: 2 -suhteessa (BA2+: Vai niin--A
- Alumiinibromidi
Alb -3, (3+Br-), 1: 3 -suhteessa (3+: 3br--A
- Rautaoksidi (III)
Usko2JOMPIKUMPI3, (Usko3+JOMPIKUMPI2-), Suhteessa 2: 3 (2fe3+: 32--A
- Strontiumioksidi
SRO, (SR2+JOMPIKUMPI2-), 1: 1 -suhteessa (SR2+: JOMPIKUMPI2--A
- Hopeakloridi
Agcl, (AG+Cl-), 1: 1 -suhteessa (AG+: Cl--A
- Toiset
-CH3Cona, (valitse3Kujertaa-Naa+), 1: 1 -suhteessa (CHO3Kujertaa-: Na+-A
- Nh4Minä (NH4+Yllyttää-), 1: 1 -suhteessa (NH4+: Yo--A
Jokaisella näistä yhdisteistä on ioninen sidos, jossa miljoonat ionit, jotka vastaavat niiden kemiallisia kaavoja, houkuttelevat sähköstaatisesti ja ne ovat kiinteitä. Mitä suurempi sen ionisten kuormitusten suuruus, sitä voimakkaammat nähtävyydet ja sähköstaattiset torjut ovat.
Siksi ioninen sidos on yleensä vahvempi, sitä suurempia ionien varauksia, jotka muodostavat yhdisteen.
Voi palvella sinua: alkeenitRatkaisut
Joitakin harjoituksia, jotka asettavat ionisen linkin perustiedot, ratkaistaan alla.
- Harjoitus 1
Mikä seuraavista yhdisteistä on ioninen? Vaihtoehdot ovat: hf, h2Tai, nah, h2S, NH3 ja MgO.
Ionisella yhdisteellä on oltava ioninen sidos määritelmän mukaan. Mitä suurempi ero elektronegatiivisuudessa sen komponenttielementtien välillä, sitä suurempi mainittu linkin ioninen luonne.
Siksi vaihtoehdot, joilla ei ole metallista elementtiä, hylätään periaatteessa: HF, H2Tai, h2S ja nh3. Kaikki nämä yhdisteet muodostavat vain ei -metalliset elementit. Kationi NH4+ Se on poikkeus tästä säännöstä, koska siinä ei ole metallia.
Jäljellä olevat vaihtoehdot ovat NAH ja MGO, joilla on vastaavasti NA- ja MG -metallit, yhdistyneitä ei -metallisiin elementteihin. Nah (na+H-) ja MGO (MG2+JOMPIKUMPI2-) Ne ovat ionisia yhdisteitä.
- Harjoitus 2
Harkitse seuraavaa hypoteettista yhdistettä: AG (NH4-A2Yhteistyö3Yllyttää. Mitkä ovat ionit ja missä osassa on kiinteä?
Hajottaa yhdisteen heidän ioneillaan: AG+, Nh4+, Yhteistyö32- ja minä-. Nämä liitetään sähköstaattisesti suhteessa 1: 2: 1: 1 (AG+: 2NH4+: Co32-: Yo--A. Tarkoittaa, että kationien määrä NH4+ On kaksinkertaista, että ag -ioneille+, Yhteistyö32- ja minä-.
- Harjoitus 3
Kumman seuraavista yhdisteistä odotetaan periaatteessa, että vahvin ioninen linkki oli? Vaihtoehdot ovat: kbr, cas, na2Sw4, Cuo, alpo4 ja pb3P4.
KBR koostuu k -ioneista+ ja br-, Kuormituksen suuruudella. Sitten CAS: lla on Ca -ionit2+ ja s2-, Kaksoismäärän kuormilla, joten voidaan ajatella, että ioninen linkki CAS: ssä on vahvempi kuin KBR: ssä; Ja myös vahvempi kuin NA: ssa2Sw4, kuten jälkimmäinen koostuu Na -ioneista+ Ja niin42-.
Sekä CAS: lla että Cuolla voi olla yhtä suuri vahva ionilinkki, koska molemmat sisältävät ioneja kaksoismäärän kuormituksella. Sitten meillä on alpoa4, ionien kanssa al3+ ja Po43-. Näillä ioneilla on kolminkertainen suuruuskuorma, joten ioninen linkki Alpossa4 Sen pitäisi olla vahvempi kuin kaikissa yllä olevissa vaihtoehdoissa.
Ja lopuksi, meillä on voittaja PB3P4, No, jos oletamme, että ionit muodostavat sen, niistä tulee pb4+ Ja p3-. Heidän kuormillaan on suurimmat suuruudet; Ja siksi PB3P4 Se on yhdiste, jolla on todennäköisesti vahvin ionisidos.
Viitteet
- Whitten, Davis, Peck & Stanley. (2008). Kemia. (8. ed.-A. Cengage -oppiminen.
- Shiver & Atkins. (2008). Epäorgaaninen kemia. (Neljäs painos). MC Graw Hill.
- Wikipedia. (2020). Ionisidos. Haettu: vuonna.Wikipedia.org
- Helmestine, Anne Marie, PH.D -d. (11. helmikuuta 2020). Ionic vs kovalenttiset sidokset - Ymmärrä ero. Toipunut: Admingco.com
- Enyclopaedia Britannica -toimittajat. (31. tammikuuta 2020). Ionisidos. Encyclopædia britannica. Toipunut: Britannica.com
- Kemikoolan sanakirja. (2017). Määritelmä ioninen sitoutuminen. Toipunut: Chemicool.com
- « Granratarian tasapainoominaisuudet, osat ja kuinka sitä käytetään
- Rutherfordin historian atomimalli, kokeet, postulaatit »

