Rutherfordin historian atomimalli, kokeet, postulaatit
- 4141
- 1211
- Juan Breitenberg V
Hän Rutherford Atomic -malli Se on brittiläisen fyysikon Ernest Rutherfordin (1871-1937) luoman atomin kuvaus, kun hän löysi vuonna 1911 atomi-ytimen nimettyjen kuuluisten dispersiokokeiden ansiosta, jotka on nimetty.
Atomin idea ("jakamaton”Kreikan kielellä) aineen pienimpänä osana, se oli muinaisessa Kreikassa syntynyt älyllinen luomus, noin 300.C. Kuten niin monet muut kreikkalaiset käsitteet, atomin käsite kehitetään logiikan ja väitteiden perusteella, mutta ei kokeiluun.
 Rutherford Atomic -malli
Rutherford Atomic -malli Merkittävimmät atomifilosofit olivat Abderan demokraatti (460 - 360 eKr.), SAMOS: n (341 - 270 AC) ja Tito Lucrecio (98 - 54 AC) Epicurus. Kreikkalaiset suunnittelivat neljä erityyppistä atomia, jotka vastasivat neljää elementtiä, jotka niiden mukaan muodostivat asian: ilma, vesi, maa ja tuli.
Myöhemmin Aristoteles lisäisi viidennen elementin: tähdet muodostava eetteri, koska muut neljä elementtiä olivat puhtaasti maanpäällisiä.
Suuren Aleksanterin valloitukset, joista Aristotelle oli opettaja, laajensi hänen uskomuksiaan muinaiselle maailmalle Espanjasta Intiaan ja siten vuosisatojen ajan ajatus ajatuksesta atomi Hän loi oman paikkansa tiedemaailmassa.
[TOC]
Atomi lakkaa olemasta jakamattomia
Kreikkalaisten filosofien ideoita aiheen rakenteesta pidettiin tiettyinä satojen vuosien ajan, kunnes englantilainen kemisti ja opettaja nimeltään John Dalton (1776-1844) julkaisi hänen kokeidensa tulokset vuonna 1808.
Dalton oli yhtä mieltä siitä, että elementit koostuvat erittäin pienistä hiukkasista, nimeltään atomeiksi. Mutta se meni pidemmälle sanomalla, että kaikki saman elementin atomit ovat yhtä suuret, ne ovat samankokoisia, sama massa ja samat kemialliset ominaisuudet, mikä tekee niistä pysymättömänä kemiallisen reaktion aikana.
Tämä on ensimmäinen atomimalli, jolla on tieteellinen perusta. Kreikkalaisten tavoin Dalton jatkoi atomin pitämistä jakamattomaksi, siksi puuttuen rakenne. Daltonin nero kuitenkin sai hänet tarkkailemaan yhtä fysiikan säilyttämisen suurista periaatteista:
- Kemiallisissa reaktioissa, Atomeja ei ole luotu eikä tuhota, He vain muuttavat jakeluaan.
Ja vakiinnutti tavan, jolla kemialliset yhdisteet muodostuivat ”yhdistymisatomilla” (molekyylit):
- Kun kaksi tai useampia eri elementtien atomia yhdistetään saman yhdisteen muodostamiseksi, ne tekevät niin aina massan mittasuhteissa määritelty ja vakio.
Yhdeksännentoista vuosisadan oli suuri vuosisata sähkön ja magneettisuuden vuosisadalla. Muutaman vuoden kuluttua Daltonin julkaisuista joidenkin kokeiden tulokset kylväivät epäilyksiä tutkijoiden keskuudessa atomin jakamattomuudesta.
Voi palvella sinua: mikä on kapasitiivinen reaktanssi ja kuinka laskea se?Crookes -putki
Crookes-putki oli laite, jonka on suunnitellut brittiläinen kemisti ja meteorologi William Crookes (1832-1919). Koe, jonka Crookes suoritti vuonna 1875, koostui asettamisesta, putken sisällä, joka oli täynnä kaasua matalapaineessa, kaksi elektrodia, toinen nimeltään katodi Ja toinen nimeltään anodi.
Laadimalla potentiaalieron molempien elektrodien välillä, kaasu loisti värillä, joka oli ominainen käytetylle kaasulle. Tämä tosiasia viittasi siihen, että atomisessa oli tietty erityinen organisaatio ja että siksi se ei ollut jakamattomia.
Lisäksi tämä säteily tuotti heikon fluoresenssin katodin edessä olevassa lasiputken seinämässä, leikkaamalla putken sisällä sijaitsevan ristinkuvannan merkin varjot.
Se oli salaperäinen säteily, joka tunnetaan nimellä "katodisäteet", joka matkusti suorassa viivassa anodiin ja joka oli erittäin energinen, pystyi tuottamaan mekaanisia vaikutuksia ja joka poikkeaa kohti positiivisesti ladattua levyä tai myös magneeteja.
Elektronin löytäminen
Crookes -putken säteilyä ei voitu käsitellä, koska sillä oli negatiivinen kuorma. Joseph John Thomson (1856 - 1940) löysi vastauksen vuonna 1887, kun hän löysi tämän säteilyn kuorman ja massan välisen suhteen ja havaitsi, että se oli aina sama: 1,76 x 10yksitoista C/kg., Putkeen lukitusta kaasusta tai katodin valmistukseen käytetystä materiaalista riippumatta.
Thomson kutsui näitä hiukkasia kekselit. Mittaamalla sen massan suhteessa sähkövaraukseensa, se päätteli, että jokainen selostus oli paljon pienempi kuin atomi. Siksi hän ehdotti, että heidän tulisi olla osa heitä, löytäen siten elektroni.
Britannian tutkija oli ensimmäinen, joka hahmotteli atomin graafista mallia piirtämällä palloa lisättyihin pisteisiin, joille muodossaan annettiin "Ciruelan Buddin" nimitys "Buddin". Mutta tämä löytö toi muita kysymyksiä:
- Jos asia on neutraali ja elektronilla on negatiivinen kuorma: missä atomin osa on positiivinen kuorma, joka neutraloi elektronit?
- Jos elektronimassa on alhaisempi kuin atomin, niin mistä loput atomi koostuu?
- Miksi hiukkaset saatiin aina elektroneja ja eivät koskaan toisen tyyppisiä?
Rutherfordin dispersiokokeet: Atomi -ydin ja protoni
Vuoteen 1898 mennessä Rutherford oli tunnistanut kahden tyyppiset säteily uraanista, jota hän kutsui alfa ja beeta.
Marie Curie oli jo löytänyt luonnollisen radioaktiivisuuden vuonna 1896. Alfahiukkasilla on positiivinen kuorma ja ne ovat yksinkertaisesti helium -ytimiä, mutta tuolloin ytimen käsitettä ei vielä tiedetty. Rutherford aikoi löytää sen.
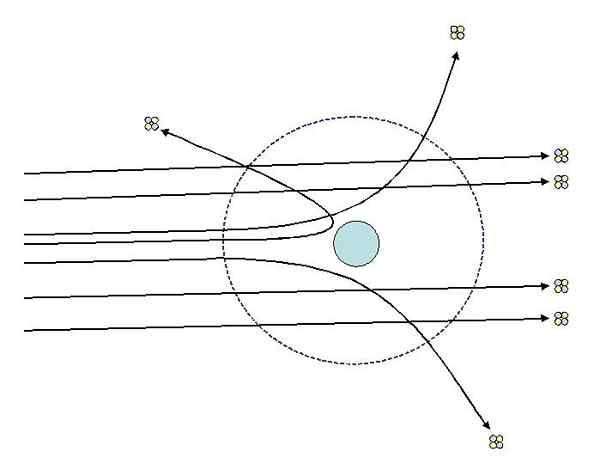
Voi palvella sinua: Termodynaaminen järjestelmä: Ominaisuudet, tyypit, esimerkitYksi kokeista, jotka Rutherford teki vuonna 1911 Manchesterin yliopistossa, Hans Geigerin avulla koostui hienon kultalevyn pommittamisesta hiukkasilla alfa, jonka kuorma on positiivinen. Kultalevyn ympärille sijoitti loisteputken, jonka avulla he voivat visualisoida pommituksen vaikutukset.
Havainnot
Tutkiessaan vaikutuksia fluoresoivaan näytökseen, Rutherford ja sen avustajat havaitsivat, että:
- Suuri prosenttiosuus alfahiukkasista ylitti arkin ilman huomattavaa poikkeamaa.
- Jotkut poikkeavat melko voimakkaassa kulmassa
- Ja hyvin vähän palautui taaksepäin
 Rutherford Dispersion -kokeet. Lähde: [CC BY-Sa 3.0 (http: // creativecommons.Org/lisenssit/by-SA/3.0/]].
Rutherford Dispersion -kokeet. Lähde: [CC BY-Sa 3.0 (http: // creativecommons.Org/lisenssit/by-SA/3.0/]]. Havainnot 2 ja 3 yllättivät tutkijoita ja saivat heidät olettamaan, että hajautetuista säteistä vastaavalla henkilöllä tulisi olla positiivinen varaus ja että havainnointinumeron 1 ansiosta vastaavalla henkilöllä oli paljon pienempi kuin alfahiukkaset.
Rutherford itse sanoi tässä suhteessa, että se oli "... ikään kuin yrittäisit 15 tuuman merivoimien ammusta paperiarkkiin ja ammus palasi takaisin ja lyö sinut". Tämä voidaan ehdottomasti selittää Thompson -mallilla.
Analysoimalla sen tulokset klassisesta näkökulmasta, Rutherford oli löytänyt atomi ytimen olemassaolon, jossa tämän neutraalisuuden antaman atomin positiivinen taakka oli keskittynyt.
Rutherford jatkoi leviämiskokeitaan. Vuoteen 1918 mennessä alfahiukkasten uusi kohde oli kaasumaisen typen atomit.
Tällä tavalla se havaitsi vety -ytimet ja tiesi heti, että ainoa kohta, josta nämä ytimet voivat tulla itse typestä. Kuinka oli mahdollista, että vety ytimet olivat osa typpeä?
Rutherford ehdotti sitten, että vetyydin, elementin, jolle jo annettu atominumero 1, tulisi olla perushiukkas. Soitan hänelle protoni, Kreikkalainen sana nimettäväksi ensimmäinen. Siten atomien ytimen ja protonin löytöt johtuvat tästä loistavasta neozyestä.
Posulats Rutherfordin atomimalli
Uusi malli oli hyvin erilainen kuin Thompson. Nämä olivat hänen postulaatit:
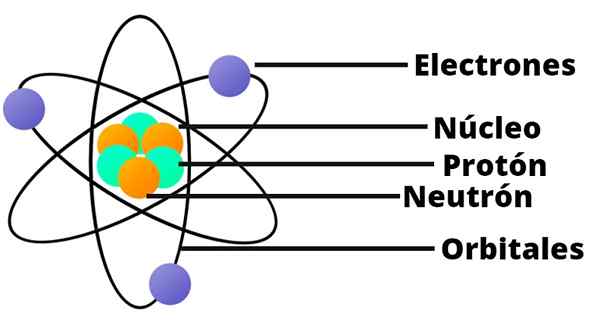
- Atomi sisältää positiivisesti kuormitetun ytimen, joka on erittäin pienestä huolimatta, sisältää melkein koko atomin massan.
- Elektronit kiertävät atomiydin suurella etäisyydellä ja pyöreissä tai elliptisissä kiertoradalla.
- Atomin nettokuorma on tyhjä, koska elektronien varaukset kompensoivat ytimessä olevan positiivisen kuorman.
Rutherfordin laskelmat osoittivat pallomaiseen ytimeen ja niin pieneen radioon kuin 10-viisitoista m, on atomisäteen arvo noin 100.000 kertaa korkeampi, koska ytimet ovat suhteellisen hyvin kaukana toisistaan: luokkaa 10-10 m.
 Nuori Ernest Rutherford. Lähde: Tuntematon, julkaistu vuonna 1939 Rutherfordissa: RT: n elämä ja kirjeet. Kunniamerkki. Lordi Rutherford tai. M [CC 4: llä.0 (https: // creativecommons.Org/lisenssit/by/4.0)]
Nuori Ernest Rutherford. Lähde: Tuntematon, julkaistu vuonna 1939 Rutherfordissa: RT: n elämä ja kirjeet. Kunniamerkki. Lordi Rutherford tai. M [CC 4: llä.0 (https: // creativecommons.Org/lisenssit/by/4.0)] Tämä selittää, miksi useimmat alfahiukkaset ylittivät arkin ilman haittoja tai tuskin kokenut hyvin pienen taipuman.
Päivittäisissä esineissä nähty Rutherfordin atomi koostuisi baseballin koon ytimestä, kun taas atomisäde olisi noin 8 km. Siksi atomia voidaan pitää melkein kaikkea tyhjänä tilana.
Pieno -aurinkokunnan samankaltaisuuden ansiosta se kutsuttiin "atomin planeettamalliksi". Ytimen ja elektronien välinen sähköstaattinen vetovoima olisi analoginen auringon ja planeettojen välisen painovoiman vetoomuksen kanssa.
Rajoitukset
Joistakin havaittuista tosiasioista oli kuitenkin tiettyjä erimielisyyksiä:
- Jos ajatus siitä, että elektronin kiertoradalla ytimen ympärillä hyväksytään, tapahtuu, että elektronin tulisi jatkuvasti säteilee säteilyä, kunnes se törmää ytimeen, sen seurauksena atomin tuhoaminen paljon vähemmän kuin sekunnissa. Tämä onneksi se ei ole mitä todella tapahtuu.
- Lisäksi tietyissä tilanteissa atomi säteilee tietyt sähkömagneettisen säteilyn taajuudet, kun tapahtuu siirtymiä suuremman energian tilan välillä, jolla on vähemmän energiaa, ja vain ne taajuudet, ei muille. Kuinka selittää tosiasia, että energia on kvantisoitu?
Näistä rajoituksista huolimatta ja että nykyään on paljon hienostuneempia malleja, ja havaittujen tosiasioiden mukaan Rutherfordin atomimalli on edelleen hyödyllinen opiskelijalle, jolla on ensimmäinen onnistunut lähestymistapa atomiin ja sen aineosiin.
Tässä atomin mallissa neutronia ei ilmesty, toinen ytimen ainesosa, jota löydettiin vasta vuonna 1932.
Lyhyen ajan kuluttua siitä, kun Rutherford ehdotti hänen planeettamallia, vuonna 1913 tanskalainen fyysikko Niels Bohr muuttaa häntä selittämään, miksi atomia ei tuhota, ja olemme edelleen täällä kertoakseni tämän tarinan.
Kiinnostavia artikkeleita
Schrödinger Atomic -malli.
Broglie -atomimalli.
Chadwick Atomic -malli.
Heisenberg Atomic -malli.
Perrin Atomic -malli.
Thomson Atomic -malli.
Dirac Jordan Atomic -malli.
Democritus Atomic -malli.
Bohr -atomimalli.
Dalton Atomic -malli.
Viitteet
- Rex, a. 2011. Fysiikan perusteet. Pearson. 618-621.
- Zapata, f. 2007. Luokan muistiinpanot radiobiologiasta ja radiologisen suojelun tuolista. Venezuelan keskustan kansanterveyskoulu.

