Pauling -asteikko
- 1979
- 174
- Edgar VonRueden
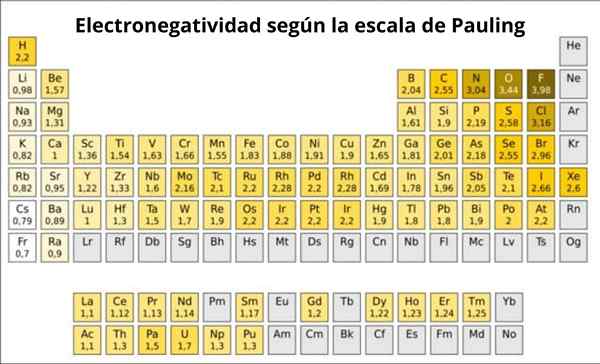 Kuvio 1. Pauling -asteikko. Lähde: Wikimedia Commons.
Kuvio 1. Pauling -asteikko. Lähde: Wikimedia Commons. Mikä on Pauling -asteikko?
Se Pauling -asteikko Se on mielivaltainen asteikko, jota käytetään kemiassa ilmaistakseen Elektronegatiivisuus elementtien. Tämä määritellään tietyn atomin taipumukseksi houkutella elektroneja yhdistettynä toiseen atomiin.
Tässä mielessä korkeat elektronegatiivisuuselementit yleensä saavat elektroneja helposti. Nämä ovat ei -metallia, vaikka heidän puolestaan, vähemmän elektronegatiivisia elementtejä, kuten metallit, heidän on helpompi tuottaa elektroneja.
Siksi elementin elektronegatiivisuuden tuntemisella on idea linkkityypistä, joka pystyy muodostamaan yhdistettynä toiseen. Näemme tämän numeerisella esimerkillä myöhemmin.
Tämän tiedon avulla voit ennustaa monia yhdisteiden ominaisuuksia, jotain erittäin hyödyllistä kokeellisessa kemiassa ja materiaalien tieteessä, jossa luodaan jatkuvasti uusia yhdisteitä.
On kuitenkin kätevää selventää, että huolimatta siitä, kuinka tärkeästä se on, ei ole ainutlaatuista tapaa määrittää elektronegatiivisuus; Pauling -asteikko on vain yksi erilaisista muodoista, jotka ehdotetaan sen löytämiseksi, vaikka se on yksi eniten käytetyistä.
Itse asiassa Pauling's on mielivaltainen asteikko, jossa jaksollisen taulukon jokaiselle elementille osoitetaan numeerinen arvo, joka heijastaa sen elektronegatiivisuutta. Näemme sen kuvassa 1, jossa sinulla on kunkin elementin elektronegatiivisuus, kuten kahdesti Nobel-palkinto Linus Pauling (1901-1994) osoitti noin vuonna 1939.
Elementtien elektronegatiivisuus
Pauling, Don M: n vieressä. Yost löysi elektronegatiivisuusarvot empiirisesti kokeellisen tiedon avulla, joka saatiin mittaamalla linkkienergiaa.
Pauling osoitettu fluorille.0 -. Joten kun fluori muodostaa yhteyksiä, sillä on korkein suuntaus houkutella elektroneja kaikkien elementtien keskuudessa.
Se voi palvella sinua: koordinaationumero: mikä on, laskenta, esimerkitToinen on happea, 3: lla.5 ja kolmas on typpi 3: lla.0 -. Molemmat sijaitsevat pöydän ylä- ja oikealla puolella.
Toisaalta, vastakkaisessa päässä, vähiten elektronegatiivinen elementti on cesium, jonka symboli on CS, joka sijaitsee taulukon vasemmalla puolella, jonka Pauling osoitti numeron 0.7.
Elektronegatiivisuus jaksollisessa taulukossa
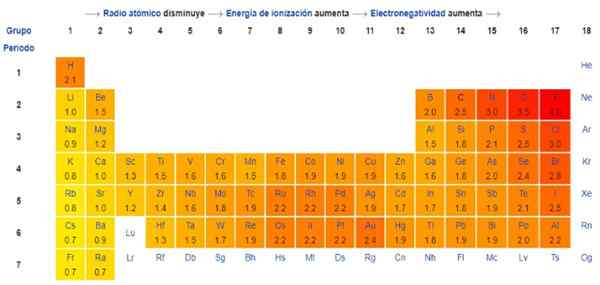
Yleensä ja kuviossa 1 havaittu elektronegatiivisuus - ionisaatioenergia - kasvaa vasemmalta oikealle jaksollisessa taulukossa. Yleinen suuntaus osoittaa myös laskua siirtyessään ylhäältä alas.
Siksi kaikkein elektronegatiivisimmat elementit ovat taulukon oikeassa yläkulmassa: fluori, happi, kloori, typpi. Vähiten elektronegatiivinen -tai elektropositiivinen, jos ne ovat edullisia -ovat vasemmalla: litium, natrium, kalium ja muut ryhmän 1 elementit -äärimmäisen vasemman pylvään, joka vastaa alkalista ja alkalisista metalleista-.
Jokaisessa sarakkeessa elektronegatiivisuus vähenee lisäämällä elementin atomilukua, paitsi siirtymämetalleissa keskustassa, jotka eivät noudata tätä suuntausta.
Tärkeä kohokohta on, että elektronegatiivisuus on suhteellista, se ei ole kunkin elementin muuttumaton ominaisuus, ja se mitataan vain muiden elementtien suhteen. Se riippuu paljon hapettumistilasta, joten sama elementti voi osoittaa erilaista elektronegatiivisuutta riippuen muodostetun yhdisteen tyypistä.
Linkittää energiaero
 Kuva 2. Amerikkalainen kemisti Linus Pauling vuonna 1955. Lähde: Wikimedia Commons.
Kuva 2. Amerikkalainen kemisti Linus Pauling vuonna 1955. Lähde: Wikimedia Commons. Kemiassa linkki on tapa, jolla atomit yhdistetään, samat tai erilaiset, molekyylien muodostamiseksi. Atomien joukossa ovat voimat, jotka pitävät ne yhdessä vakaina.
Linkkejä on useita tyyppejä, mutta kaksi otetaan huomioon tässä:
- Kovalenttinen, jossa samanlaisten elektronegatiivien atomit jakavat pari elektronia.
- Ioninen, Usein atomien välillä, joilla on erilaisia elektronegativiteetteja, joissa sähköstaattinen vetovoima vallitsee.
Oletetaan, että kaksi elementtiä A E B voi muodostaa molekyylejä toistensa kanssa, merkitty AA ja BB. Ja he voivat myös liittyä muodostamaan AB -yhdisteen, kaiken tyyppisen linkin kautta.
Molekyylien välisten voimien osallistumisen ansiosta linkissä on energiaa. Esimerkiksi AA -linkin energia on EAA, BB -linkissä on ebb ja lopulta yhdisteessä AB on EAb.
Jos AB -molekyyli muodostuu kovalenttisella sidoksella, teoreettisesti linkin energia on energian keskiarvo jaAA ja eBb-
JAAb = ½ (EAA + JABb-A
Pauling laskettu EAb Useille yhdisteille se mittasi sen kokeellisesti ja määritteli eron kahden arvon välillä, jota se kutsui δ: δ:
Δ = | (EAb) mitattu - (EAb) Teoreettinen | = | (EAb) mitattu - ½ (EAA + JABb) |
Pauling perusteltiin näin: Jos δ on hyvin lähellä 0, se tarkoittaa, että molempien elementtien elektronegativiteetti on samanlainen ja ne yhdistävä linkki on kovalenttinen. Mutta jos δ ei ole pieni, niin linkki A: n ja B: n välillä ei ole puhdasta kovalenttia.
Mitä suurempi Δ: n absoluuttinen arvo, sitä suurempi ero elementtien a ja b elektronegatiivisuuden välillä ja siten linkki, että UNE on ionista tyyppiä. Myöhemmin lukija löytää esimerkin, jossa laskettaessa δ on mahdollista määrittää yhdisteen linkin tyyppi.
Elektronegatiivisuuden yhtälöt
Alkaen siitä tosiasiasta, että energian ero on signaali, joka erottaa linkin luonteen, Pauling teki monia kokeita, jotka johtivat hänet luomaan empiirisen ekspression kahden elementin suhteelliselle elektronegatiivisuudelle E B: lle, joka muodostaa molekyylin.
Merkittämällä sellaista elektronegatiivisuutta kuin χ (kreikkalainen kirjain "Chi"), Pauling määritteli δ seuraavasti:
F2· Δ = [χ (a) - χ (b)]2
χ (a) - χ (b) = f√δ = 0.102√δ
Voi palvella sinua: Tanteo -tasapaino: vaiheet, esimerkit ja harjoituksetHuomaa, että δ on positiivinen määrä. Fatia f = 0.102, joka näyttää kertovan Δ: n neliöjuuren, on muuntokerroin KJ: n (kilojoules) ja EV: n (elektroni-voltin) välillä, molemmat energiayksiköt.
Jos käytetään sen sijaan kilokalororioita ja elektroni-voltia.208:
χ (a) - χ (b) = 0.208 seinät
Pauling aloitti vedyn arvon 2.1, kemisti Robert Mullikenin aikaisempi arvo. Hän valitsi tämän elementin lähtökohtana, koska se muodostaa kovalenttiset yhteydet moniin muihin.
Edellisen yhtälön kautta hän jatkoi muihin elementteihin liittyvien arvojen määrittämistä. Se huomasi, että elektronegatiivisuus kasvaa, kun se siirtyy vasemmalta oikealle ja ylhäältä alaspäin jaksollisessa taulukossa, kuten edellisessä osassa on kuvattu.
Esimerkki
Alla on luettelo elementeistä: N, J ja M ja niiden vastaavat elektronegativiteetit χ Pauling -asteikon mukaan:
-N: Χ = 4.0 -
-J -: Χ = 1.5
-JA: Χ = 0.9
-M: Χ = 1.6
Seuraavista heidän kanssaan muodostetuista yhdisteistä:
Yj, yn, mn ja jm
Osoita yksi, jolla on suurin ioninen luonne ja jonka luonne on kovalenttinen. Syy vastauksesi.
Ratkaisu
Paulingin asettamien kriteerien mukaan yhdiste, jolla on suurin ioninen luonne. Se puolestaan yhdiste, jolla on alhaisin energiaero, on se, jolla on kovalenttinen sidos.
Sitten laskemme kuinka paljon δ on jokaiselle yhdisteelle arvoinen, seuraavasti:
Yhdistelmä YJ
Δ = [χ (y) - χ (j)]2 = (0.9 - 1.5)2 = 0.36
YN -yhdiste
Δ = [χ (y) - χ (n)]]2 = (0.9 - 4.0)2 = 9.61
Mn yhdiste
Δ = [χ (m) - χ (n)]2 = (1.6 - 4.0)2 = 5.76
JM -yhdiste
Δ = [χ (j) - χ (m)]2 = (1.5 - 1.6)2 = 0.01
Edellä olevista tuloksista seuraa, että ionisen luonteen yhdiste on YN, jonka Δ = 9.61, kun taas kovalenttisen merkin yhdiste on JM, Δ = 0: lla.01.

