Kaasumaiset valtion ominaispiirteet, yleinen laki, esimerkkejä

- 912
- 20
- Arthur Terry II
Hän Kaasumainen tila Se on sen kohteen aggregaatiotila, jossa hiukkaset pidetään yhdessä heikojen vuorovaikutusten avulla, kykenevä liikkumaan ne sisältävän säiliön kaikki ohjeet. Kaikista kohteen fyysisistä tiloista kaasuma on se, joka osoittaa suurimman vapauden ja kaaoksen.
Kaasut painostavat, kuljetuslämpö ja koostuvat minkä tahansa tyyppisistä pienistä hiukkasista. Ilmapiiri ja hengittämämme ilma on osoitus kaasumaisesta tilasta täällä maan päällä.
 Savun emaanissa kaasujen käyttäytyminen voidaan havaita ennen kuin ne leviävät ilmakehän läpi. Lähde: Pexels.
Savun emaanissa kaasujen käyttäytyminen voidaan havaita ennen kuin ne leviävät ilmakehän läpi. Lähde: Pexels. Kaasuesimerkkejä ovat kasvihuonekaasut, kuten vesihöyry, hiilidioksidi, metaani tai otsoni. Hiilidioksidi, jota hengitämme hengityksessä, on toinen esimerkki kaasumaisesta aineesta.
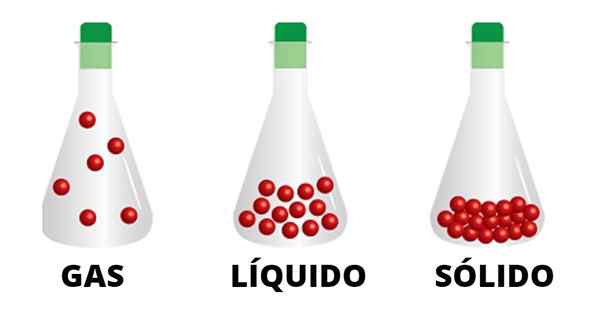 Kaasumaiset hiukkaset yhdistetään heikojen vuorovaikutusten avulla ja liikkuvat säiliön avulla. Havaitaan, että nestemäisen tilan hiukkaset ovat yhtenäisempiä ja tiiviisti sidoksissa olevan kiinteiden kiinteiden kiinteistöjen hiukkasia
Kaasumaiset hiukkaset yhdistetään heikojen vuorovaikutusten avulla ja liikkuvat säiliön avulla. Havaitaan, että nestemäisen tilan hiukkaset ovat yhtenäisempiä ja tiiviisti sidoksissa olevan kiinteiden kiinteiden kiinteistöjen hiukkasia Esimerkiksi nesteet ja kiinteät aineet eivät siirry asentoihin omien materiaalirajojensa ulkopuolella, tosiasia, jota ei tapahdu kaasujen kanssa. Savukkeiden, savupiippujen ja tornien savu osoittaa itselleen, kuinka kaasu nousee ja hajaantuu ympäristöstä, ilman mitään pysäyttämättä sitä.
[TOC]
Kaasumaiset tilan ominaisuudet
Sillä ei ole äänenvoimakkuutta tai muotoa
Kaasumaiselle tilalle on ominaista, että sillä ei ole määriteltyä muotoa tai tilavuutta. Jos sen säilyttämiseen ei ole rajoja, se leviää koko ilmakehään. Jopa heliumin kanssa, se pakenee maan ulkopuolella.
Kaasu voi hankkia vain säiliön asettaman muodon. Jos säiliö on lieriömäinen, kaasulla "on" sylinterin muoto.
Voi palvella sinua: Kalorimetria: Mitä tutkimuksia ja sovelluksiaHuono lämmönkuljettaja
Tälle valtiolle on ominaista myös olla huono sekä lämmön että sähkön johdin. Yleensä se on vähemmän tiheä verrattuna kiinteisiin ja nestemäisiin tiloihin.
Koska suurin osa kaasuista on väritöntä, kuten happea ja hiilidioksidia, voidaan määrittää, kuinka suuri osa niistä on säiliössä niiden paineen mittauksen avulla.
Reagenssit
Kaasut ovat yleensä reaktiivisempia, paitsi jalokaasut kuin nesteet tai kiinteät.
Pienet hiukkaset
Kaasumaiset hiukkaset ovat myös yleensä pieniä, ne ovat atomeja tai yksinkertaisia molekyylejä.
Esimerkiksi kaasumainen vety, H2, Se on hyvin pieni molekyyli, jonka muodostuu kahdella vetyatomilla. Meillä on myös helium, hän, jonka atomit ovat vielä pienempiä.
Vuorovaikutus
Vuorovaikutukset kaasumaisessa tilassa ovat halveksivia. Tämä eroaa suuresti nestemäisistä ja kiinteistä tiloista, joissa niiden hiukkaset ovat erittäin yhtenäisiä ja ovat vuorovaikutuksessa voimakkaasti toisistaan. Niissä molekyyleissä, jotka muodostavat nestemäiset ja kiinteät tilat, niiden joukossa on tuskin mitään molekyylin tyhjyyttä.
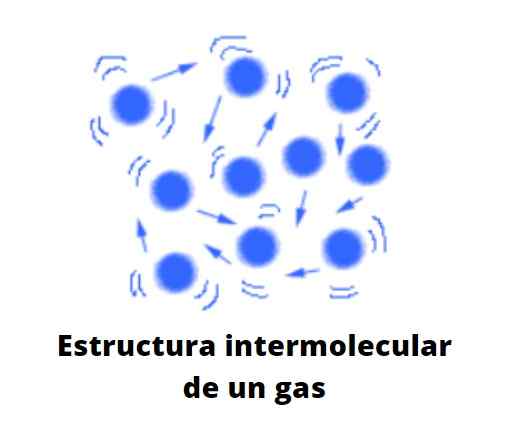
Kaasumaisen tilan hiukkaset ovat hyvin etääntyneet yksi muista, niiden joukossa on paljon tyhjyyttä. Se ei ole enää tyhjiö molekyyliasteikolla. Niitä erottava etäisyys on niin paljon, että jokainen kaasun hiukkas on vapaa, välinpitämätön ympäristölle, ellei kaoottisessa etenemissuunnassaan toisen hiukkasen kanssa tai säiliön seinää vasten.
Voi palvella sinua: laimennettu liuosJos oletetaan, että astiaa ei ole, kaasuhiukkasten välinen tyhjyys voi miehittää ilmaa, joka työntää ja vetää kaasua kohti sen virran suuntaa. Siksi ilma, joka koostuu kaasumaisesta seoksesta, kykenee muodonmuutokseen ja levittämään kaasumaisia aineita, kunhan ne eivät ole paljon tiheämpiä kuin hän.
Yleinen kaasumainen osavaltion laki
Kaasujen käyttäytymisen ja mekaniikan kokeellinen tutkimus johti useisiin laeihin (Boyle, Charles, Gay-Lussac), jotka yhdistyvät ennustamaan, mitkä kaasujärjestelmän tai ilmiön parametrit ovat, ts. Mikä on sen lämpötila, tilavuus, tilavuus tilavuus ja paine.
Tällä yleisellä lailla on seuraava matemaattinen ilmaisu:
P = kt/v
Missä k on vakio, p paine ja tilavuus ja t kaasun lämpötila Kelvin -asteikolla. Siten, kun tiedät kaksi muuttujaa (sanoen, p ja v), kolmas voidaan puhdistaa, mikä olisi tuntematon (t).
Tämä laki sallii esimerkiksi sen, minkä pitäisi olla kaasun lämpötila, lukkiutuneen tilavuuden V säiliöön, P -paineen näyttämiseksi.
Jos lisäämme Amadeus Avogadron panoksen tähän lakiin, meillä on sitten ihanteellinen kaasulaki, johon sisältyy myös hiukkasten lukumäärä ja niiden kanssa kaasun molaaripitoisuus:
P = nrt/v
Missä n vastaa kaasun moolien lukumäärää. Yhtälö voidaan kirjoittaa uudelleen:
P = CRT
Missä c Se on kaasun molaarinen pitoisuus (n/V). Siten saadaan yleisestä laista ihanteellinen laki, joka kuvaa, kuinka ihanteellisen kaasun paine, pitoisuus, lämpötila ja tilavuus liittyy.
Voi palvella sinua: seulottuEsimerkkejä kaasumaisesta tilasta
Kaasumaiset elementit
Sama jaksollinen taulukko tarjoaa hyvän ohjelmiston esimerkeistä elementeistä, jotka esitetään maan päällä kaasuina. Niiden välillä meillä on:
-Vety

-Helium
-Typpi
-Happi
-Fluori
-Kloori
-Neon
-Argoni
-Kripton
-Ksenoni
Tämä ei tarkoita, että muista elementeistä ei voi tulla kaasumaista. Esimerkiksi metallit voidaan muuttaa kaasuiksi, jos niihin kohdistuu korkeampia lämpötiloja kuin niiden kiehumispisteet. Siten siellä voi olla raudan, elohopean, hopean, kultaa, kuparia, kehä-, iridium-, osmio -hiukkasia; minkä tahansa metallin.
Kaasumaiset yhdisteet
Seuraavassa luettelossa meillä on joitain esimerkkejä kaasumaisista yhdisteistä:
-Hiilimonoksidi, CO
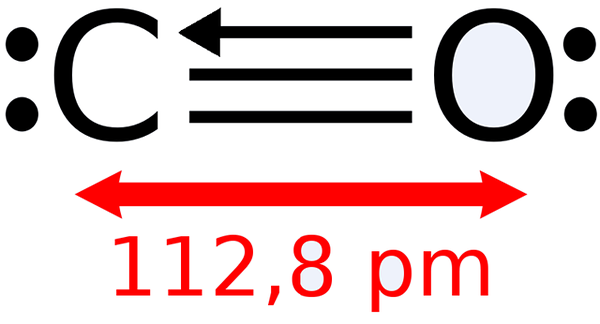 Hiilimonoksidin Lewis -rakenne
Hiilimonoksidin Lewis -rakenne -Hiilidioksidi, CO2 (kaasu, joka muodostaa uloshengityksen)
-Ammoniakki, NH3 (Vital -aine teollisuusprosessien sinfiineille)
-Rikkitrioksidi, niin3
-Metaani, ch4 (Kotimainen kaasu, jonka kanssa se on kypsennetty)
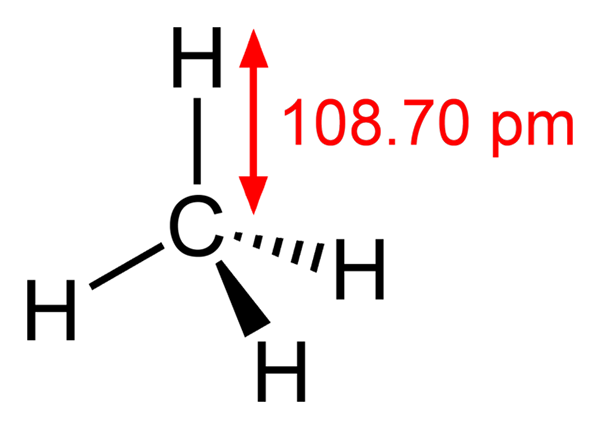 Metaanirakenne
Metaanirakenne -Etano, ch3CH3
-Typpidioksidi, ei2 (Ruskea värillinen kaasu)
-Fosgen, cocl2 (erittäin myrkyllinen aine)
-Ilma (on typen, hapen, argonin ja muiden kaasujen seos)
-Vesihöyry, h2Tai (joka on osa pilviä, geiserejä, koneiden höyrystimiä jne.-A.
-Asetyleeni, hc irti
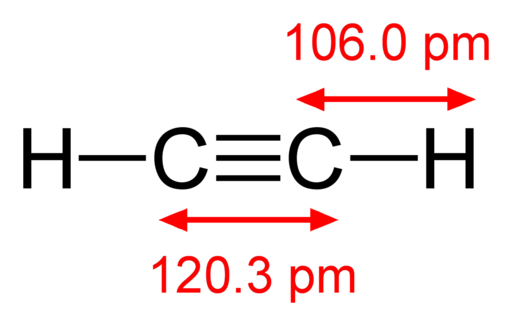 Asetyleenin rakennekaava
Asetyleenin rakennekaava -Jodihöyryt, minä2 (Violetti värikaasu)
-Heksafluoruro rikki, sf6 (erittäin tiheä ja raskas kaasu)
-Hydratsiini, n2H4
-Vetykloridi, HCl (joka liuenneen veteen tuottaa suolahappoa)
Viitteet
- Whitten, Davis, Peck & Stanley. (2008). Kemia. (8. ed.-A. Cengage -oppiminen.
- Wikipedia. (2020). Kaasu. Haettu: vuonna.Wikipedia.org
- Edward a. Muurari. (6. helmikuuta 2020). Kaasu. Encyclopædia britannica. Toipunut: Britannica.com
- Helmestine, Anne Marie, PH.D -d. (11. helmikuuta 2020). Kaasun määritelmä ja esimerkki kemiassa. Toipunut: Admingco.com
- María Estela Raffino. (12. helmikuuta 2020). Mikä on kaasumainen tila? Toipunut: Konsepti.-

