Europio -rakenne, ominaisuudet, hanki, käyttää

- 1628
- 326
- Eddie Hackett
Hän Europio Se on harvinaisille maametalle kuuluva kemiallinen elementti, jota edustaa EU: n kemiallinen symboli ja jonka nimi on ilmeisesti Euroopan mantereelle. Tämä on harvinaisten maametallien reaktiivisin, vertaamalla litiumia, kalsiumia ja bariumia, minkä vuoksi sen mineraloginen diffuusio on hyvin dispergoitu.
Se on yksi harvinaisimmista ja kalliimmista metalleista, koska kaikki toimenpiteet, jotka on tehtävä epäpuhtauksien vapauttamiseksi. Fyysisesti se osoittaa harmahtavaa kultaista hehkua, joka johtuu sen nopeasta hapettumisesta, se on tuskin altistunut ilmalle. Siksi on harvoin mahdollista säilyttää sen aitolla hopeavärillä.
 Hapettunut europium. Lähde: Hi-Res-kuvat kemiallisista elementeistä/CC kirjoittanut (https: // creativecommons.Org/lisenssit/by/3.0)
Hapettunut europium. Lähde: Hi-Res-kuvat kemiallisista elementeistä/CC kirjoittanut (https: // creativecommons.Org/lisenssit/by/3.0) Euroopum on niin reaktiivinen, että se on säilytettävä ampuuleihin tai suljettuihin astioihin inerttien argon -ilmakehän alla. Pieni liuenneen hapen hapetus hapetetaan jopa mineraaliöljyyn upotettuna.
Euroopion erinomainen piirre on sen luminesenssi, erityisesti sen yhdisteissä havaittu hapettumisnumero +3, kuten Yhdysvallat2JOMPIKUMPI3, joka on punainen fosfori, jota käytetään elektronisten laitteiden äärettömyydessä, ja myös euroiden lippuissa sen väärentämisen estämiseksi.
[TOC]
Europio -löytö
Euroopion löytö luotiin osittain koko 1800 -luvun ajan ja Euroopan mantereen eri maissa (Ruotsissa, Saksassa ja Sveitsissä). Europium -ioneja oli vaikea tunnistaa, koska niiden absorptiospektrit sekoitettiin muiden harvinaisten maametallien, kuten mäen, gadoliniumin ja Lantheanin, kanssa, samoin kuin samarium.
Siksi kaikkien näiden metallien tunnistaminen ja eristäminen veti europiumin epäpuhtauteen karakterisoimalla. Esimerkiksi Cerio -näytteen eristäminen, vuonna 1839 Carl Gustav Mosander, oli tuotteena muiden uusien elementtien tunnistaminen: Lantano ja Didimio.
Tutkiessaan Didimioa ja johtopäätöstä tehtiin, että se todella koostui muiden elementtien (prooseodyymi ja neodyymi) seoksesta, Samario ilmestyi, jonka Paul èmile Lecoq.
Voi palvella sinua: alumiinihydridi (ALH3): rakenne, ominaisuudet, käyttötarkoituksetMyöhemmin, vuonna 1886, sveitsiläinen kemisti Jean Charles Galissard puhdistettu samariuminäytteet löytävät Gadolinion. Vuoden 1892 Lecoq oli jo tutkinut Gadolinion ja toisen uuden elementin spektriä.
Viisitoista vuotta myöhemmin, vuonna 1901, ranskalainen kemisti Eugène Anatole DeMarcay eristi lopulta tämän uuden elementin ja kastoi sen europiumiksi, Euroopan kunniaksi.
Europiumin kemiallinen rakenne
Europium -atomit pysyvät yhtenäisinä metallisen sidoksen ansiosta, osallistumalla siihen 4f- ja 6s -orbitaaliensa elektroneihin. Euroopan elektronisten ominaisuuksiensa, atomiradioiden ja pakkausmuodon seurauksena europium päätyy omaksumaan kehoon keskittyvä kuutiomainen rakenne (BCC), joka on yksi vähiten tiheä.
Ei ole bibliografisia lähteitä, joissa mainitaan toinen Europio -polymorfia, lukuun ottamatta mainittua BCC -vaihetta, muilla lämpötila -alueilla; Mutta erilaisissa paineissa.
Esimerkiksi 18 GPA: n paineeseen toimitetulle paineeseen toimitetulla europiumilla on kompakti kuusikulmainen rakenne ja muuttuu sitten lopulta monokliiniseksi vaiheeksi 31: n suurempiin paineisiin.5 GPA.
Elektroninen kokoonpano
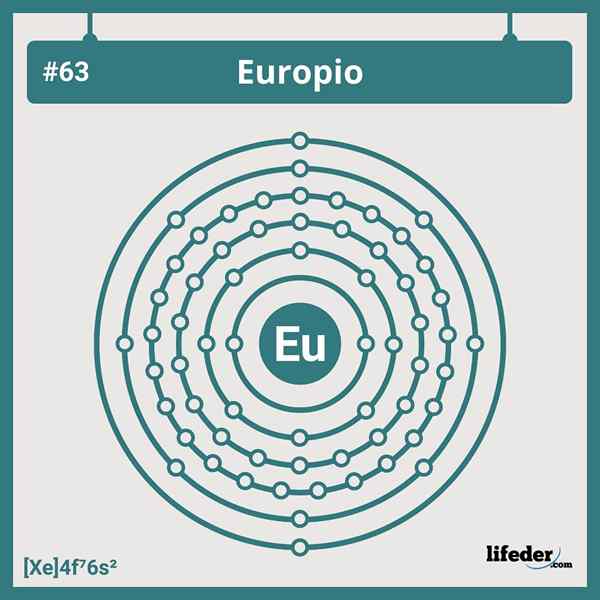 Elektroninen europiumkokoonpano
Elektroninen europiumkokoonpano Europiumin lyhennetty elektroninen kokoonpano on:
[Xe] 6s24F7
Lantanide -sarjan paikoillaan tai ryhmässä 7 on seitsemän elektronia, jotka miehittävät 4f -kiertoradan; Ja siksi se ei vastaa mitään poikkeamia, jotka löydämme jaksollisen taulukon elementtien elektronisista kokoonpanoista.
Europio -kiinteistöt
Fyysinen ulkonäkö
Hopeavalkoinen metalli, pehmeä kovuus, joka on samanlainen kuin lyijy ja joka muuttuu kultaiseksi, kun se altistetaan ilmalle, peittäen kerros oksidia ja karbonaattia.
Atominumero
63
Moolimassa
151.96 g/mol
Sulamispiste
826 ºC
Kiehumispiste
1529 ºC
Tiheys
Kiinteä: 5.264 g/cm3
Sulamispisteessä: 5.13 g/cm3
Hapetustilat
Euroopion tärkeimmät hapetustilat ovat +2 (EU2+) ja +3 (EU3+), Olla +1 (EU+) Vähiten yleinen kolmesta.
Voi palvella sinua: Polar Covalent Link: Ominaisuudet ja esimerkitIonisaatioenergiat
-Ensimmäinen: 547.1 kJ/mol (EU+ kaasumainen)
-Toinen: 1085 kJ/mol (EU2+ kaasumainen)
-Kolmas: 2404 kJ/mol (EU3+ kaasumainen)
Elektronegatiivisuus
1.2 Pauling -asteikolla.
Magneettinen järjestys
Paragneettinen
Reaktiivisuus
Euroopion reaktiivisuus on verrattavissa litiumin reaktioon, ja siksi se on harvinaisten maametallien reaktiivisin metalli. Esimerkiksi reagoi nopeasti veden kanssa vastaavan hydroksidin, EU (OH) muodostamiseksi3, Keltainen, joka toisin kuin alkaliset hydroksidit ovat liukenematon veteen:
2 eu + 6 h2O → 2 EU (OH)3 + 3 h2
Lisäksi, kun se palaa Yhdysvaltoihin hapettuneessa kevyemmässä2JOMPIKUMPI3 Ja hylkäsi punertavan liekin, joka muistutti litiumia:
4 eu + 3 o2 → 2 EU2JOMPIKUMPI3
Euroopum kykenee muodostamaan monia yhdisteitä +2: n hapettumistilaan, koska sillä on kiertoradat F Puoli täynnä (4f7), joka antaa atomilleen epätavallisen elektronisen stabiilisuuden.
EU: n kationi2+ esittelee kemiallisen käyttäytymisen, joka on samanlainen kuin BA2+, Mutta toisin kuin jälkimmäinen, se toimii kohtalaisen vahvana pelkistävänä aineena, hapettaen Yhdysvaltoja3+.
Saada
Raaka materiaali
Euroopion on läsnä harvinaisten maametallien mineraaleissa, kuten bastnasita ja monasiitti. Koska se kuitenkin pitää jonkin verran samankaltaisuutta alkali- ja emäksisistä metalleista niiden reaktiivisuuden suhteen, niiden ionit ovat hyvin hajallaan maan aivokuoressa kalsiumimineraalien tai muiden metallien vieressä, joten pelkästään mineraaleja ei ole, että se on runsaasti europiumissa. Siksi hankkimaasi on erittäin kallista.
Prosessit
EU -ionit3+ Ne ovat osa monia ruosteita ja harvinaisia maametallia. Siksi ensimmäinen askel on erottaa ne muista läsnä olevista metalleista. Tätä varten mineraalit käsitellään, etenkin bastnasiitti; Niitä kosketetaan, liukenevat vahvoihin happoihin tai emäksiin, ja fraktioidut sateet altistetaan käyttämällä erilaisia reagensseja. Samoin ioninvaihtokromatografiaa käytetään Yhdysvaltojen erottamiseen3+.
Mineraalin prosessoinnin yhteydessä saadaan eu -ionien konsentraatti3+, jota voidaan vähentää käyttämällä metallista sinkkiä tai siitä amalgaamia, niin että ne pelkistetään Yhdysvaltoihin2+. Sitten Yhdysvallat2+ Pariliitos karbonaatin tai bariumsulfaatin kanssa.
Voi palvella sinua: katalyyttinen hydrausTätä sakkaa pidetään ja tapahtuu erottelu EU: n oksidin saamiseksi2JOMPIKUMPI3, joka pelkistetään Lantanon kanssa Tantalion sulatuskantissa, lopulta distaloa ja tiivistämään metallinen europium.
Toinen menetelmä europiumin saamiseksi on suorittaa EUCL: n seoksen elektrolyysi3 ja NaCl tai CACl2 sulaa. Siten kloorikaasu tapahtuu anodissa, kun taas metallinen Europio muodostuu katodissa.
Käyttää/sovelluksia
 Tässä eurolipussa havaittu punertavan luminesenssi UV -lampun alla johtuu europiumyhdisteestä. Lähde: repro h. Grobe/cc by (https: // creativecommons.Org/lisenssit/by/3.0)
Tässä eurolipussa havaittu punertavan luminesenssi UV -lampun alla johtuu europiumyhdisteestä. Lähde: repro h. Grobe/cc by (https: // creativecommons.Org/lisenssit/by/3.0) Euroopion metallisessa muodossaan puuttuu rutiininkäyttö. Sen yhdisteet ovat kuitenkin toinen tarina, etenkin sen EU -oksidi2JOMPIKUMPI3, jonka fosforesenssi on tehnyt laitteiden, näytöiden ja televisioiden näytöiden välttämättömällä komponentilla. Tämä johtuu siitä, että se on punainen fosfori, joka säteilee ominaisen punaisen valon.
Europion (III) punertavaa fosforesenssia käytetään myös estämään euroslippuja väärentämistä, valaisevat UV -valoa sen legitiimiyden vahvistamiseksi.
Toisaalta, kun se sekoitetaan euro (II) -yhdisteiden kanssa, jotka ovat sinertäviä, saadaan valkoinen valo, hyvin toistuva loistelamppujen lasissa.
Europiumia lisätään pieninä määrinä strontiumaluminaattiin eri väreiden fosforien valmistamiseksi, jotka erottuvat pitkän aikavälin fosforesenssin kanssa.
Viitteet
- Shiver & Atkins. (2008). Epäorgaaninen kemia. (Neljäs painos). MC Graw Hill.
- Kansallinen bioteknologiatietojen keskus. (2020). Europium. Pubchem -elementin yhteenveto. Toipunut: Pubchem.NCBI.Nlm.NIH.Hallitus
- Wikipedia. (2020). Europium. Haettu: vuonna.Wikipedia.org
- Enyclopaedia Britannica -toimittajat. (2020). Europium. Toipunut: Britannica.com
- R -. J -. Aviomies et ai. (27. elokuuta 2012). Europium-IV:. Toipunut: lehdet.APS.org
- Daavid. Skowron. (26. marraskuuta 2017). Mihin europiumia käytetään? - Yleinen ja historiallinen käyttö. Opiskelu. Toipunut: Opiskelu.com
- DR. Doug Stewart. (2020). Europium -elementit. Toipunut: Chemicool.com
- « Monoteismin alkuperä, ominaispiirteet ja uskonnot
- Kulttuurierot käsite ja esimerkkejä maiden välillä »

