Puristuskerroin kuinka laskea, esimerkkejä ja harjoituksia
- 2776
- 699
- Alonzo Kirlin
Hän Puristuskerroin z, o Kaasujen pakkauskerroin on ulottumaton arvo (ilman yksiköitä), joka otetaan käyttöön korjauksena ihanteellisissa kaasujen tilayhtälössä. Tällä tavalla matemaattinen malli muistuttaa kaasun havaittua käyttäytymistä enemmän.
Ihanteellisessa kaasussa muuttujiin P (paine), V (tilavuus) ja T (lämpötila) liittyvä tilayhtälö on: P.V ihanteellinen = n.R -.T N = moolien lukumäärä ja r = Ihanteellisten kaasujen vakio. Lisäämällä z -puristuskertoimen korjaus, tämä yhtälö muutetaan:
P.V = z.n.R -.T
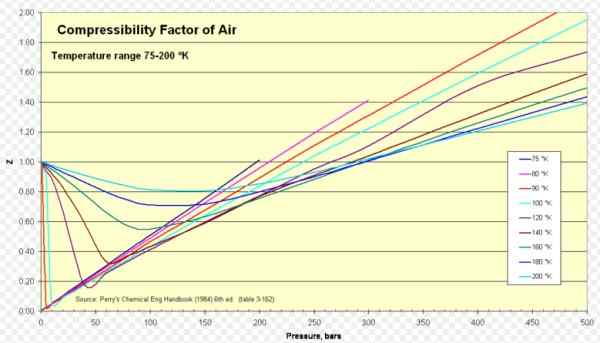
 Kuvio 1. Ilman puristuskerroin. Lähde: Wikimedia Commons. https: // Lataa.Wikimedia.org/wikipedia/commons/8/84/compressbility_factor_of_air_75-200_k.Png.
Kuvio 1. Ilman puristuskerroin. Lähde: Wikimedia Commons. https: // Lataa.Wikimedia.org/wikipedia/commons/8/84/compressbility_factor_of_air_75-200_k.Png. [TOC]
Kuinka laskea puristuskerroin?
Ottaen huomioon, että molaarinen määrä on Vviileä = V/n, Sinulla on todellinen molaarinen tilavuus:
P . Vtodellinen = Z. R -. T → z = pv todellinen/RT
Koska Z -puristuskerroin riippuu kaasuolosuhteista, se ilmaistaan paineen ja lämpötilan funktiona:
Z = z (p, t)
Vertaamalla kahta ensimmäistä yhtälöä, on huomattava, että jos moolien lukumäärä n on yhtä kuin 1, todellisen kaasun molaaritilavuus liittyy ihanteellisen kaasun määrään läpi:
Vtodellinen / Vihanteellinen = Z → V todellinen = Z vihanteellinen
Kun paine ylittää 3 ilmakehän.
Tämä toteutti hänen kokeilussaan hollantilainen fyysikko Johannes van der Waals (1837-1923), joka johti hänet luomaan mallin, joka sopeutui paremmin käytännön tuloksiin kuin ihanteellisten kaasujen yhtälö: van der Waalsin tilayhtälö.
Voi palvella sinua: natriumoksalaatti (NA2C2O4): rakenne, ominaisuudet, käytöt, riskitEsimerkit
Yhtälön mukaan P.Vtodellinen= Z.n.Rt, Ihanteelliselle kaasulle Z = 1. Todellisissa kaasuissa paineen lisäämällä myös z: n arvo. Tämä on järkevää, koska suuremmilla painekasvamolekyyleillä on enemmän mahdollisuuksia törmätä, joten torjuminen voimat kasvavat ja siten tilavuus.
Toisaalta pienempiä painetta, molekyylit liikkuvat suuremmalla vapaudella ja torjuntavoimat vähenevät. Siksi odotetaan pienempää tilavuutta. Lämpötilan suhteen, kun se kasvaa, Z laskee.
Kuten van der Waals havaitsi, niin hyvin makeisen kriittisen pisteen läheisyydessä kaasun käyttäytyminen on hyvin ohjattu ihanteellisesta kaasusta.
Kriittinen kohta (tc, Pc) minkä tahansa aineen paine- ja lämpötila -arvot, jotka määrittävät niiden käyttäytymisen ennen vaihemuutosta:
-Tc Se on lämpötila, jonka yläpuolella kyseistä kaasua ei nesteytetä.
-Pc Kaasun nesteyttämiseen vaaditaan vähimmäispaine lämpötilassa tc
Jokaisella kaasulla on oma kriittinen kohta, mutta lämpötilan ja alentuneen paineen T määritteleminenr - Ja pr - seuraavasti:
Pr - = P / pc
Vr - = V /vc
Tr - = T /tc
Havaitaan, että kaasu rajoittuu identtiseen Vr - ja Tr - Aseta sama paine Pr -. Tästä syystä, jos Z on graafinen riippuen Pr - samaan Tr -, Jokainen käyrän kohta on sama kaikille kaasulle. Tätä kutsutaan Vastaavien tilojen periaate.
Puristuskerroin ihanteellisissa kaasuissa, ilmassa, vedyssä ja vedessä
Alla on puristuskäyrä eri kaasuille eri alennetuissa lämpötiloissa. Sitten joitain esimerkkejä z: stä joillekin kaasuille ja menetelmä z: n löytämiseksi käyrällä.
Voi palvella sinua: vety: historia, rakenne, ominaisuudet ja käytöt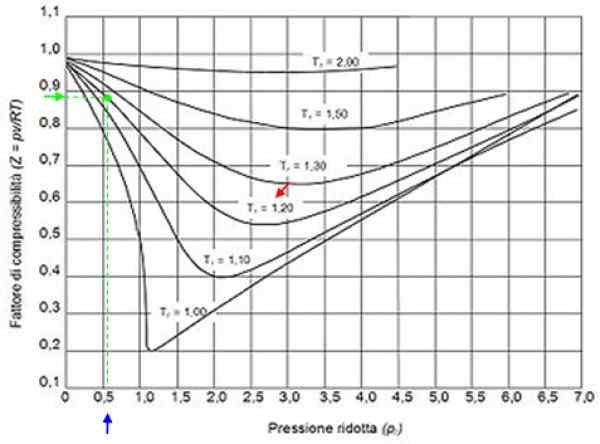 Kuva 2. Graafinen tekijägrafiikka kaasuille vähentämispaineen mukaan. Lähde: Wikimedia Commons.
Kuva 2. Graafinen tekijägrafiikka kaasuille vähentämispaineen mukaan. Lähde: Wikimedia Commons. Ihanteelliset kaasut
Ihanteellisilla kaasuilla on z = 1, kuten alussa selitetään.
Ilma
Air Z on noin yksi laajassa lämpötilojen ja paineiden alueella (katso kuva 1), missä ihanteellinen kaasumalli antaa erittäin hyviä tuloksia.
Vety
Z> 1 kaikille paineille.
Vettä
Veden z: n löytämiseksi tarvitaan kriittisen pisteen arvot. Veden kriittinen kohta on: Pc = 22.09 MPa ja Tc= 374.14 ° C (647.3 k). Jälleen on tarpeen ottaa huomioon, että Z -puristuskerroin riippuu lämpötilasta ja paineesta.
Oletetaan esimerkiksi, että haluat löytää z: n vedestä 500 ºC: n ja 12 MPa. Sitten ensimmäinen on laskea alentunut lämpötila, jolle Celsius -asteet on siirrettävä Kelvinille: 50 ºC = 773 K:
Tr - = 773/647.3 = 1.2
Pr - = 12/22.09 = 0.54
Näillä arvoilla löydetään kuvan kuvaaja, joka vastaa tr - = 1.2, ilmoitettu punaisella nuolella. Sitten katsomme vaaka -akselilla p: n arvoar - lähempänä 0.54, merkitty sinisellä. Nyt piirrämme pystysuoran, kunnes T -käyrä sieppataanr - = 1.2 Ja lopuksi se projisoidaan siitä pisteestä pystysuoraan akseliin, missä luimme likimääräisen arvon z = 0.89.
Ratkaisut
Harjoitus 1
Lämpötilassa 350 K on kaasunäyte ja 12 ilmakehän paine, molaarinen tilavuus 12 % korkeampi kuin ihanteellisella kaasulaki ennustaa. Laskea:
a) Z -pakkauskerroin.
b) kaasun molaarinen tilavuus.
Voi palvella sinua: peruuttamaton reaktio: Ominaisuudet ja esimerkitc) Edellä olevien tulosten mukaan ilmoita, jotka ovat tämän kaasunäytteen hallitsevia voimia.
Tiedot: r = 0,082 L.atm/mol.K -k -
Liittää jhk
Tietäen sen v todellinen on 12 % korkeampi kuin Vihanteellinen -
Vtodellinen = 1.12Vihanteellinen
Z = v todellinen / Vihanteellinen = 1.12
Ratkaisu b
P . Vtodellinen = Z. R -. T → Vtodellinen = (1.12 x 0.082 x 350/12) l /mol = 2.14 l/mol.
Liuos C
Hyödytysvoimat ovat vallitsevia, koska näytteen tilavuus kasvoi.
Harjoitus 2
Etataania on 10 moolia, joiden tilavuus on 4.86 L A 27 ºC. Löydä etaanin painostusta:
a) Ihanteellinen kaasumalli
b) Van der Waals -yhtälö
c) Etsi pakkauskerroin aiemmista tuloksista.
Tiedot etaanista
Van der Waals -kertoimet:
A = 5.489 DM6. Pankkiautomaatti . molo-2 ja b = 0.06380 DM3. molo-1.
Kriittinen paine: 49 atm. Kriittinen lämpötila: 305 K
Liittää jhk
Lämpötila siirretään Kelvinille: 27 º C = 27 +273 K = 300 K, muista myös, että 1 litra = 1 L = 1 DM3.
Sitten ihanteellisessa kaasuyhtälössä toimitetut tiedot korvataan:
P.V = n.R -.T → P = (10 x 0,082 x 300/4.86 l) ATM = 50.6 ATM
Ratkaisu b
Van der Waalsin tilayhtälö on:
Missä A ja B ovat lausunnon antamat kertoimet. Kun puhdistetaan p:
Liuos C
Laskemme alennetun paineen ja lämpötilan:
Pr - = 35.2/49 = 0.72
Tr - = 300/305 = 0.98 ≈ 1
Näiden arvojen kanssa etsitään z: n arvoa kuvan 2 kaaviossa, toteaa, että Z on noin 0.7.
Viitteet
- Atkins, p. 1999. Fysikaalinen kemia. Omega -versiot.
- Cengel, ja. 2012. Termodynamiikka. 7mehu Painos. McGraw Hill.
- Engel, t. 2007. Johdanto fysikaalis -ohjelmaan: Termodynamiikka. Pearson.
- Levine, i. 2014. Fysiikan kemian periaatteet. Kuudes. Painos. McGraw Hill.
- Wikipedia. Puristuvuuskerroin. Haettu: vuonna.Wikipedia.org.

