Kasvaimen nekroositekijä (TNF) rakenne, toimintamekanismi, toiminta
- 1506
- 378
- Joshua Emmerich
Hän Kasvaimen nekroositekijä (TNF), joka tunnetaan myös nimellä caquektiini, on luonnollisesti tuotettu proteiini ihmiskehon ja muiden nisäkkäiden fagosyyttisissä tai makrofagisoluissa. Se on erittäin tärkeä sytoquine, joka osallistuu sekä normaaleihin fysiologisiin prosesseihin että kehon patologisten prosessien monimuotoisuuteen.
Hänen löytönsä on peräisin hieman yli 100 vuotta sitten, kun w. Coley käytti raa'ita bakteeriuutteita kasvainten hoitoon eri potilailla ja havaitsi, että näillä uutteilla oli kyky indusoida näiden kasvainten nekroosi, samalla kun potilaiden systeeminen tulehduksellinen reaktio potilailla.
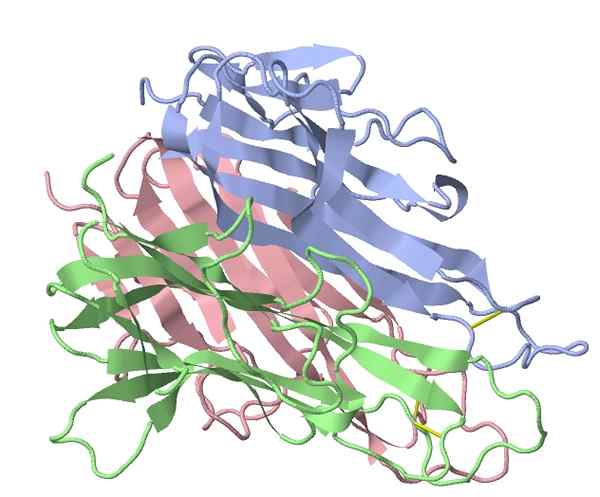
 Kasvaimen nekroosi Alfa-hiiren tekijä (lähde: TK Vallery/CC BY-SA (https: // creativecommons.Org/lisenssit/by-SA/3.0) Wikimedia Commonsin kautta)
Kasvaimen nekroosi Alfa-hiiren tekijä (lähde: TK Vallery/CC BY-SA (https: // creativecommons.Org/lisenssit/by-SA/3.0) Wikimedia Commonsin kautta) Coleyn käyttämien bakteeriuutteiden aktivoitu pääasiallinen ”tulehdusta” stimulaattori tunnistettiin vuonna 1975, mikä osoitti, että hoidetun potilaiden seerumin proteiinitekijä aiheutti tuumorin hajoamista, jossa tämän ryhmän tämän ryhmän tunnistava nimi syntyi proteiineja (TNF -a).
Noin 10 vuotta myöhemmin, vuonna 1984, "kasvaimen nekroositekijä" -geeni eristettiin ja karakterisoitiin, ja samaan päivään mennessä toinen samanlainen proteiini eristettiin ja puhdistettiin T -lymfosyyteissä, jota kutsuttiin "t alfa t -lymfotoksiiniksi" (TLa),, joka oli myöhemmin tunnettu TNF-β-tekijänä.
Tällä hetkellä on määritelty lukuisia lukuisia proteiineja, jotka ovat alun perin kuvattuja TNF: n, jotka muodostavat TNF-proteiiniperheen (kasvaimen nekroositekijätyyppi) ja mukaan lukien TNF-a, TNF-P-proteiinit, CD40-ligandi (CD40L), ligandi FA: t ( Fasl) ja monet muut.
[TOC]
Rakenne
Geenitasolla
TNF-a-proteiinin koodausgeeni löytyy kromosomista 6 (jyrsijöiden kromosomi 17) ja TNF-P-proteiinin koodaavasta geeni edeltää edellistä molemmissa tapauksissa (ihmisen ja jyrsijöiden). Nämä kaksi geeniä ovat yhdessä kopiossa ja niiden likimääräinen koko on 3 kb.
Koska TNF-a-geenin edistävää aluetta vastaavalla sekvenssillä on useita ammattiliittokohtia transkriptiotekijän, joka tunnetaan nimellä “Kappa B: n ydintekijä” (NF-KB), monet kirjoittajat katsovat, että niiden ekspressio riippuu tämä tekijä.
TNF-β-geenin promoottorialueella on toisaalta yhdistyssarja toiselle proteiinille, joka tunnetaan nimellä "korkea liikkuvuusryhmä 1" (HMG-1, englannista Korkea liikkuvuusryhmä 1).
Voi palvella sinua: myosiini: Ominaisuudet, rakenne, tyypit ja toiminnotProteiinitasolla
Alfa-kasvaimen nekroositekijän kaksi muotoa on kuvattu, toinen, joka on kytketty kalvoon (MTNF-a) ja toinen, joka on aina liukoinen (STNF-a). Beetakasvaimen nekroositekijä puolestaan esiintyy vain liukoisessa muodossa (STNF-p).
Ihmisillä TNF-a. Sen ilmeinen molekyylipaino on noin 26 kDa.
Tämän proteiinin translokaatio membraaniin tapahtuu sen synteesin aikana ja tämä muoto "muunnetaan" liukoiseksi muotoksi (17 kDa) entsyymillä, joka tunnetaan nimellä "TNF-a: n muuntava entsyymi", joka kykenee muuttamaan MTNF-a: n STNF: ksi -a.
Toimintamekanismi
Kasvaimen nekroositekijäryhmään (TNF) kuuluvat proteiinit käyttävät toimintoja pääasiassa niiden yhteydenpidon kanssa ihmisen kehon solujen ja muiden eläinten spesifisten reseptoreiden kanssa.
TNF-proteiineille on kahta tyyppiä suuren osan kehon solujen plasmamembraaneissa, lukuun ottamatta erytrosyyttejä: tyypin I reseptorit (TNFR-55) ja tyypin II reseptorit (TNFR-75).
Molemmilla reseptorityypeillä on rakenteellinen homologia TNF -proteiinien solunulkoisen unionin kohdan suhteen ja sitoudut myös näihin ekvivalenttien affiniteetin kanssa. Ne eroavat silloin solunsisäisillä signalointireiteillä, jotka aktivoivat, kun ligandi-vastaanottimen sitoutuminen on tapahtunut.
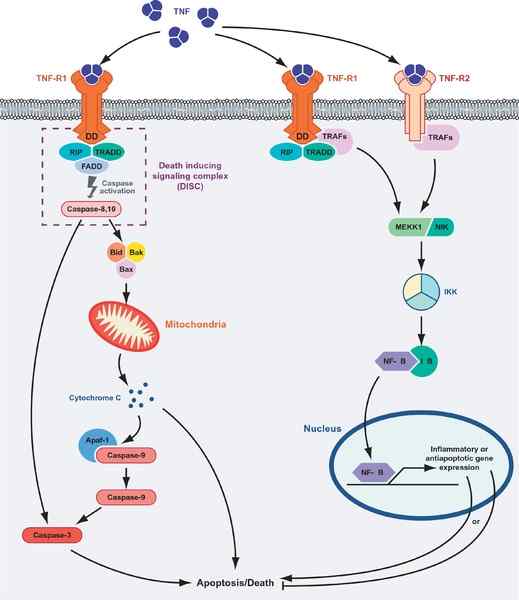 Solukuolema tai eloonjääminen TNF -proteiinien välittämä. Graafisen vasemmalla puolella apoptoottinen reitti on esitetty ja ”eloonjäämisreitti” (lähde: Masudur M. Rahman, Grant McFadden/CC by (https: // creativecommons.Org/lisenssit/by/1.0) Wikimedia Commonsin kautta)
Solukuolema tai eloonjääminen TNF -proteiinien välittämä. Graafisen vasemmalla puolella apoptoottinen reitti on esitetty ja ”eloonjäämisreitti” (lähde: Masudur M. Rahman, Grant McFadden/CC by (https: // creativecommons.Org/lisenssit/by/1.0) Wikimedia Commonsin kautta) TNF: n ligandireseptoreiden vuorovaikutus minkä tahansa sen reseptoreiden kanssa edistää kolmen reseptorin liukoista TNF-a miehitetty.
Unioni tyypin I reseptoreissa
Ligandireseptoriyhdistys tyypin I reseptoreiden kanssa toimii muiden signalointiproteiinien ”rekrytointialustana” reseptoreiden sytosolisissa domeeneissa (sisäinen osa). Näiden proteiinien joukossa ensimmäinen "saa" on TRADD- tai proteiiniproteiini, jolla on kuolemadomeeni, joka liittyy TNFR-1-reseptoriin (englanti TNFR-1: ään liittyvä kuolemadomeeniproteiini-A.
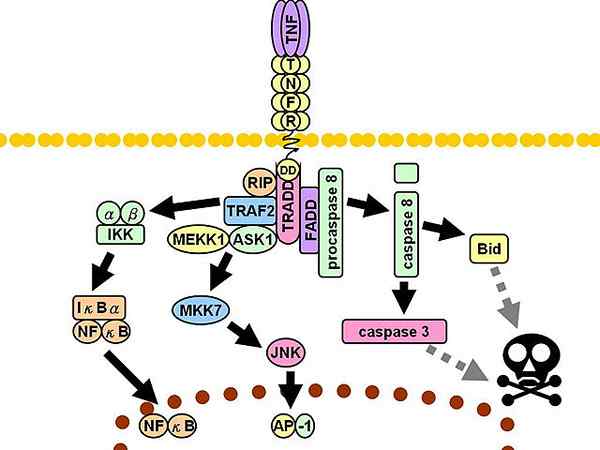 TNFR1 -signalointireitti. Epäjatkuva harmaat viivat edustavat useita vaiheita.
TNFR1 -signalointireitti. Epäjatkuva harmaat viivat edustavat useita vaiheita. Myöhemmin rekrytoidaan kolme ylimääräistä sovittelijaa: vuorovaikutusproteiini vastaanottimen 1 kanssa (RIP1, englannista Vastaanottimen aiheuttava proteiini 1), Proteiini, jolla on kuoleman domeeni, joka liittyy FAS: ään (fadd, englanti FAS: ään liittyvä kuolemadomeeniproteiini) ja tekijä 2 liittyy TNF -vastaanottimeen (TRAF2, englanti TNF-reseptoriin liittyvä tekijä 2-A.
Voi palvella sinua: fenyylialaniini: ominaisuudet, toiminnot, biosynteesi, ruokaTyypin II reseptorit
Kun TNF sitoutuu tyypin II reseptoreihin, tämä johtaa TRAF2 -proteiinin suoraan rekrytointiin, joka puolestaan rekrytoi TRAF1 -proteiinia. Nämä proteiinit aktivoivat MAPK -proteiinireitit (englannista Mytogeeniaktivoitu proteiinikinaasi), erittäin tärkeä solunsisäisen signalointilähetyksen näkökulmasta eukaryooteissa.
Monet signalointireitit, jotka aktivoituvat TNF -tekijöiden liittämisen jälkeen reseptoreihin.
Funktio
TNF-a. On kuitenkin osoitettu, että muut kehon solut tuottavat myös nämä tekijät, vaikkakin vähemmässä määrin.
Kasvaimen nekroositekijää on tutkittu sen vaikutuksista normaaleihin fysiologisiin prosesseihin, samoin kuin akuutissa ja kroonisissa tulehduksellisissa patologisissa prosesseissa, autoimmuunisairauksissa ja erityyppisiin syöpään liittyvissä tulehduksellisissa prosesseissa.
Nämä proteiinit liittyvät nopeaan painonpudotukseen potilailla, jotka kärsivät akuutista bakteeri -infektioista, jotka kärsivät syöpästä ja jotka kulkevat septisen "yhteenoton" läpi.
Kasvaimen nekroositekijälle on kuvattu kolme erilaista biologista aktiivisuutta:
- sytotoksisuus kasvainsoluja vastaan
- adiposyyttien (LPL) lipoproteiinilipaasin tukahduttaminen ja
- Myosyyttikalvon (lihassolut) lepopotentiaalin vähentäminen.
TNF-a.
Kun ärsyke bakteerien endotoksiinina havaitaan, tämä muoto on proteolypro aktiivinen TNF seerumissa ja muissa kehon nesteissä.
Voi palvella sinua: Entsyymi: toiminta ja esimerkitBiologisten toimintojensa joukossa TNF.
Estäjät
Monet lääkäreiden hoidon reseptin TNF-proteiinin estäjät potilaille, joilla on autoimmuunisairauksia (anti-TNF-hoito). Näiden aineiden joukossa ovat: infliksimabi, etanersepti, adalimumabi, golimumabi ja certolitsumabi pegol.
Yleisin käyttömuoto on ihonalaiset injektiot reidessä tai vatsassa, ja jopa suoraa laskimo -infuusiota harjoitetaan. Huolimatta siitä, kuinka suuri osa näistä aineista voi auttaa tiettyjä potilaita, niiden käyttöön liittyy joitain haittavaikutuksia, joiden joukossa on lisääntynyt infektioiden, kuten tuberkuloosi tai muut sieni -infektiot, riski.
"Luonnolliset" ei -farmakologiset estäjät
Jotkut TNF-proteiinien "leikkaus" fragmentit ovat myös tunnettuja nimellä TNF-unionin proteiinit (TNF-BPS, englanti Sitovat proteiinit tekijä nekroosikasvain) on havaittu syöpä-, aids- tai sepsispotilaiden virtsassa.
Joissakin tapauksissa nämä fragmentit estävät tai neutraloivat TNF-proteiinien aktiivisuutta, koska ne välttävät ligandireseptorin vuorovaikutusta.
Muita TNF -proteiinien "luonnollisia" estäjiä on havaittu joissakin kurkumeista ja kranaatista johdetuissa kasvituotteissa, vaikka tässä suhteessa tehdään edelleen tutkimuksia.
Viitteet
- Baud, v., & Karin, M. (2001). Signaalinsiirto tuumorinekroositekijällä ja sen sukulaisilla. Solubiologian suuntaukset, 11 (9), 372-377.
- Chu, w. M. (2013). Tekijän nekroosikasvain. Syöpälukut, 328 (2), 222-225.
- Kalliolias, G. D -d., & Ivkiv, L. B -. (2016). TNF -biologia, patogeeniset mekanismit ja nousevat terapeuttiset strategiat. Nature Reviews Rheumatology, 12 (1), 49.
- Lis, k., Kuzawińska tai., & Bałkowiec -iskra, ja. (2014). Nekroosi Kasvaimen estäjien tilan tiedon tekijä. Lääketieteen arkistot: AMS, 10 (6), 1175.
- Tracey, MD, K. J -., & Cerami, PH. Antaa. (1994). Nekroosin kasvaintekijä: pleiototrooppinen sytokiini ja terapeuttinen kohde. Vuotuinen lääketieteen katsaus, 45 (1), 491-503.
- Wu, h., & Hymowitz, S. G. (2010). Kasvaimen nekroositekijän (TNF) rakenne ja toiminta solun pinnalla. Solun signaloinnin käsikirjassa (PP. 265-275). Akateeminen lehdistö.
- « Kaliumfosfaatti (K3PO4) rakenne, ominaisuudet, käyttää
- Mikä on historian tai historiologian teoria? »

