Kaliumfosfaatti (K3PO4) rakenne, ominaisuudet, käyttää

- 3971
- 243
- Dr. Travis Reichert
Hän Kaliumfosfaatti Se on epäorgaaninen yhdiste, jonka muodostaa kolmen ionin kalium k+ ja fosfaatti -ioni PO43-. Sen kemiallinen kaava on k3Poikki4. Se on väritön kiinteä tai kiteinen valkoinen. Se on hyvin liukoinen veteen, muodostaen alkaliset liuokset, ts. Monien OH -ionien kanssa-, Siksi perus pH.
Fosfaatti -ionilla on tärkeä tehtävä soluissa, jotka liittyvät energian varastointiin. Kaliumfosfaattia käytetään laajasti orgaanisissa kemian reaktioissa, joissa se voi toimia emäksenä, toisin sanoen protonien ottaminen H+. Se voi toimia myös joidenkin reaktioiden katalyyttinä tai kiihdyttimenä.
 Kaliumfosfaatti k3Poikki4 kiinteä. Xavier13540 kiinalaisessa Wikipediassa [julkinen alue]. Lähde: Wikimedia Commons.
Kaliumfosfaatti k3Poikki4 kiinteä. Xavier13540 kiinalaisessa Wikipediassa [julkinen alue]. Lähde: Wikimedia Commons. Sitä on käytetty vähentämään vehnäkasvien tiettyjen hyönteisten hyökkäystä, koska se tekee niistä kestävämpiä näille. On kuitenkin havaittu, että se suosii metaanin irrottamista (CH4), Kasvihuonekaasu, riisimikrokulttuurit.
Sitä on käytetty laksatiivina, paikallispuudutuksen keston lisäämiseksi, karieksen lopettamiseksi ja pintojen peittämiseksi muun muassa.
[TOC]
Rakenne
Kaliumfosfaatti koostuu kolmesta kationista kalium k+ ja fosfaatti -anionin PO43-.
Fosfaatti -ioni PO43- Se muodostuu fosforin (P) atomilla ja neljällä happeatomilla (O) atomilla, joissa fosforin hapettumistila on +5 ja happi A -2 -2: n valenssi.
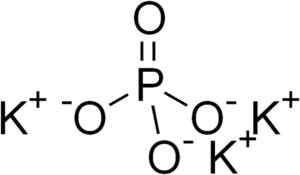 Kaliumfosfaattirakenne k3Poikki4. Edgar181 [julkinen alue]. Lähde: Wikimedia Commons.
Kaliumfosfaattirakenne k3Poikki4. Edgar181 [julkinen alue]. Lähde: Wikimedia Commons. Nimikkeistö
- Kaliumfosfaatti
- Triptosiumfosfaatti
- Kalium -tribasinen fosfaatti
- Triptosiumiortofosfaatti
Ominaisuudet
Fyysinen tila
Väritön kiinteä tai kiteinen valkoinen.
Molekyylipaino
212,27 g/mol
Sulamispiste
1340 ºC
Tiheys
2 564 g/cm3
Liukoisuus
Hyvin liukoinen veteen: 106 g/100 g vettä 25 ° C: ssa. Liukenematon etanoliin.
PHE
Liuos 1% k: lla3Poikki4 Sen pH on 11,5-12,3.
Kemialliset ominaisuudet
Liuottamalla veteen, kaliumfosfaatti erotetaan kolmeen katiooniin kalium k+ ja fosfaatti -anionin PO43-. Fosfaatti -anioni vie vettä protonin ja muodostuu HPO -vetyfosfaatti -anionia42-. Jälkimmäinen puolestaan vie toisen veden protonin ja siitä tulee dihydrogenofosfaattihuonioni2Poikki4-.
Voi palvella sinua: miten joustava materiaali syntetisoidaan?Poikki43- + H2Tai ⇔ hpo42- + vai niin-
HPO42- + H2Tai ⇔ h2Poikki4- + vai niin-
Kun muotoilla ionit OH- Vesiliuoksesta tulee emäksistä.
Muut ominaisuudet
Vedetön muodon (ilman vettä) lisäksi siinä on useita hydratoituja muotoja; Tämä tarkoittaa, että k -molekyyli3Poikki4 Siinä voi olla yksi tai useampi vesimolekyyli kiteisessä rakenteessa.
Tästä syystä voit muodostaa esimerkiksi K -monohydraatin3Poikki4.H2Tai3Poikki4.3H2Tai hepthydraatti ja ei -dehydraatti.
Fosfaattitoiminta ihmisen organismissa
Fosfaatti -ioni PO43- Se on solujen sisällä runsain anioni ja harjoittaa tärkeätä toimintoa energian varastoinnissa.
Fosfaatti -ioni osallistuu myös luiden ja hampaiden muodostumiseen ja ravitsemustoimintaan, koska se säätelee kalsiumin pitoisuutta veren seerumissa ja lukuisissa energiansiirtoreaktioissa solussa.
Saada
Kaliumfosfaatti voidaan saada Kcl -kaliumkloridin ja ammoniumfosfaatin välisestä reaktiosta (NH4-A3Poikki4.
Kaliumkloridi + ammoniumfosfaatti → kaliumfosfaatti + ammoniumkloridi
3 KCl + (NH4-A3Poikki4 → K3Poikki4 + 3 NH4Cl
Sovellukset
Orgaanisen kemian reaktioiden perusta
Kaliumfosfaatti k3Poikki4 Sitä on käytetty useissa orgaanisissa kemian reaktioissa. Esimerkiksi se palvelee asetyleenien synteesissä, joka perustuu dibromoituihin yhdisteisiin.
Tässä synteesissä tapahtuu dehydrobromatio (vedyn ja bromin eliminointi), missä k3Poikki4 Ashidro -kiinteä (ilman vettä) toimii pehmeänä pohjana ja ottaa kaksi protonia molekyylistä, kaksi bromiatomia eliminoidaan ja vastaava asetyleeni saadaan.
C6H5-CHBR-CH2Br + 2 K3Poikki4 → C6H5-C lähelläch + 2 kbr + 2 k2HPO4
 Kirjailija: Clker-Vector-kuvat. Lähde: Pixabay.
Kirjailija: Clker-Vector-kuvat. Lähde: Pixabay. Katalysaattorina
K3Poikki4 Se toimii katalysaattorina erilaisissa orgaanisissa kemian reaktioissa. Esimerkiksi sitä on käytetty kiinteänä biodieselin saamiseen käytetystä paistinöljystä.
Biodiesel on polttoaine, joka on samanlainen kuin diesel, mutta saadaan käytetyistä rasvoista tai luonnollisista öljyistä.
Voi palvella sinua: Coulombimetria: Perusteet, tyypit, sovelluksetKaliumfosfaatti oli tehokkaampi katalyyttinä tai kiihdyttimenä mainitussa reaktiossa kuin natriumfosfaatti3Poikki4 ja Cao -kalsiumoksidi.
Maataloudessa
K3Poikki4 Sitä on käytetty vehnäkasvien hoitamiseen ja tiettyjen tuholaisten kestäviin.
 Vehnäkasveja voidaan hoitaa k: lla3Poikki4 olla vastustuskykyinen tietyntyyppisille hyönteisille. Kirjoittaja: Hans Braxmeier. Lähde: Pixabay.
Vehnäkasveja voidaan hoitaa k: lla3Poikki4 olla vastustuskykyinen tietyntyyppisille hyönteisille. Kirjoittaja: Hans Braxmeier. Lähde: Pixabay. Jotkut tutkijat kokeilivat vehnän taimia kaliumfosfaatilla ja osoittautuivat, että tämä vastustus Duraphis noxia, Hyönteinen, joka hyökkää näihin kasveihin.
Laimennettu K -liuoksen levitetty3Poikki4 Taimissa näiden hyönteisten aiheuttamien oireiden ja näiden ruokinta -ruokinnan aiheuttamien oireiden vakavuus.
 Kirjoittaja: Hans Braxmeier. Lähde: Pixabay.
Kirjoittaja: Hans Braxmeier. Lähde: Pixabay. Lääketieteellisissä sovelluksissa
Kaliumfosfaattia on käytetty lidokaiinin, paikallispuudutuksen anestesiavaikutuksen modifiointiin. Paikallinen anestesia on lääke, joka levitettäessä kehon alueella aiheuttaa kivun herkkyyden menetyksen tällä alueella.
Todettiin, että k3Poikki4 Se mahdollistaa lidokaiinin paikallispuudutuksen pidentämisen.
Kuin laksatiivi
Kaliumfosfaatti lisää suolen pitoisuuden juoksevuutta, koska se auttaa pitämään vettä suolistossa, mikä epäsuorasti indusoi suolen lihaksen supistumista.
Eläinlääketieteessä
K3Poikki4 Sitä käytetään eläimissä, joilla on diabeettinen ketoasidoosi (diabeteksen komplikaatio) hypofospathian (pieni määrä fosfaattia veressä) hoitaakseen).
Kuitenkin, kun se toimitetaan ylimääräisesti, se voi aiheuttaa hypokalsemiaa (veressä vähän kalsiumia), hyperfospathiaa (veressä ylimääräinen fosfaatti), lihaksien tahaton supistuminen, pehmytkudoksen mineralisaatio ja munuaisten vajaatoiminta.
 Koirat, joilla on diabeettinen asidoosi, voidaan hoitaa kaliumfosfaatilla. Kirjoittaja: David Mark. Lähde: Pixabay.
Koirat, joilla on diabeettinen asidoosi, voidaan hoitaa kaliumfosfaatilla. Kirjoittaja: David Mark. Lähde: Pixabay. DNA: n saamiseksi
Kaliumfosfaattia on käytetty puskurina DNA: n puhdistamiseen genetiikan laboratorioissa.
DNA on soluista löydetty proteiini ja sisältää kaikki elävien olentojen kehittämiseen ja toimintaan tarvittavat geneettiset tiedot.
Se voi palvella sinua: Fraktion tislaus: prosessi, laitteet, sovellukset, esimerkitEristämällä DNA: ta, tutkijat pohtivat tutkimusta perinnöllisten hahmojen välittämisestä, joten kaliumfosfaatti on erittäin hyödyllinen.
 Piirustus DNA -molekyyli. Kirjailija: Public Domainpartures. Lähde: Pixabay.
Piirustus DNA -molekyyli. Kirjailija: Public Domainpartures. Lähde: Pixabay. Useissa sovelluksissa
Kaliumfosfaatti k3Poikki4 se palvelee:
- ruokavaliona,
- elektrolyytin vaihtoa varten,
- Puskurina, toisin sanoen kemiallisena järjestelmänä, jonka avulla OH -ionitasot voidaan hallita- tai vety h+ Vesiliuoksessa,
- Hammaskarieksen muodostumisen lopettaminen tai estäminen,
- korroosio -estäjänä ja anti -Sniff -agentina,
- Agenttina pintojen ja pinnoiteaineen hoitamiseksi,
- Ifreefeze,
- puhdistustuotteissa.
 Syöpäriputket. K3Poikki4 mahdollistaa korroosion välttämisen joidenkin toimialojen tai prosessien putkissa. Kirjoittaja: Michael Gaida. Lähde: Pixabay.
Syöpäriputket. K3Poikki4 mahdollistaa korroosion välttämisen joidenkin toimialojen tai prosessien putkissa. Kirjoittaja: Michael Gaida. Lähde: Pixabay. Negatiivinen näkökohta käytettäväksi maataloudessa
Tietyt tutkijat havaitsivat, että lisäämällä k3Poikki4 Metaanipäästöä lisätään riisimikrokulttuuriksi (valitse4) ilmakehään. Metaani on kaasu, joka myötävaikuttaa kasvihuonevaikutukseen ja planeettamme lämpötilan nousuun.
Viitteet
- TAI.S. Lääketieteen kansalliskirjasto. (2019). Kaliumfosfaatti. PubChemistä toipunut.NCBI.Nlm.NIH.Hallitus.
- Panciera, D.Lens. (2012). Fluiditerapia endokriinisissä ja aineenvaihdunnissa. Fosforilisäys. Neste-, elektrolyytti- ja happo-emäshäiriöissä pienten eläinten käytännössä (neljäs painos). ScienEdirect.com.
- Shenawi-khalil, s. et al. (2012). Asetyleenien synteesi dehydrobromaation kautta käyttämällä kiinteää vedettömiä kaliumfosfaatteja emäksenä faasinsiirto-olosuhteissa. Tetrahedron Letters, osa 53, numero 18, 2012, sivut 2295-2297. ScienEdirect.com.
- Guan, G. et al. (2009). Tri-passiumfosfaatti kiinteänä katalyyttinä biodieselin tuotantoon jäteöljystä. Polttoaineenkäsittelytekniikka, osa 90, numero 4, 2009, sivut 520-524. ScienEdirect.com.
- Kulkami, m.-Lla. (2012). Mekaaninen lähestymistapa a-hydroksifosfonaattien laajentumiseen ja liuotinvapaaseen synteesiin käyttämällä kaliumfosfaattia katalyytin kanssa. Comptes Rendus Chimie, osa 16, numero 2, 2013, sivut 148-152. ScienEdirect.com.
- Venter, E. et al. (2014). Kaliumfosfaatti indusoi toleranssia Venäjän vehnän kirvoa (Duraphis noxia, Homoptera: aphididae) vehnässä. Crop Protection Vol 61, heinäkuu 2014, sivut 43-50. ScienEdirect.com.
- Bonturi, n. et al. (2013). Natriumsitraatti ja kaliumfosfaatti vaihtoehtoisina adsorptiopuskureina hydrofobisissa ja aromaattisissa tiofiilisissä kromatografisissa puhdistuksissa plasmidi -DNA: n neutraloidusta lysaatista. Journal of Chromatography B, Volumes 919-920, 2013, sivut 67-74. ScienEdirect.com.
- Conrad, r. ja klose, m. (2005). Vaikuttaa kaliumfosfaatin hedelmöitys metaanin ja sen säteilyyn 13C-stabiili isotooppikoostumus riisimikrokosmossa. Maaperän biologia ja biokemia, osa 37, numero 11, 2005, sivut 2099-2108. ScienEdirect.com.
- Lyijy, d.R -. (Toimittaja) (2003). CRC: n kemian ja fysiikan käsikirja. 85th CRC -lehdistö.
- Savujalka. (2019). Tipotsiomfosfaatti. Haettu jstk.Wikipedia.org
- « Ominaisuuksien syöttölaitteet, mitkä ovat käyttö, tyypit, esimerkit
- Kasvaimen nekroositekijä (TNF) rakenne, toimintamekanismi, toiminta »

