Liukoisuuteen vaikuttavat tekijät
- 4686
- 689
- Gustavo Runte DVM
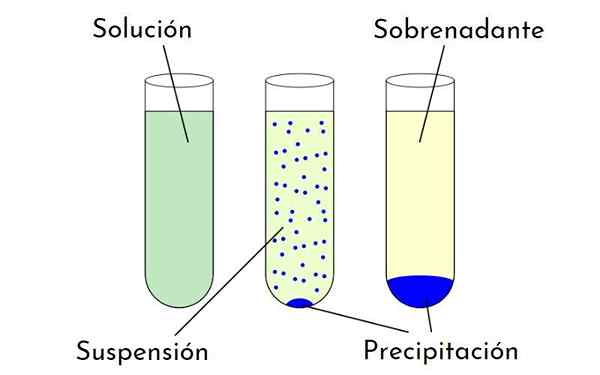
 Kaavio, joka näyttää erot liuoksen, suspension ja saostumisen välillä, jotka muodostavat sakan ja supernatantin. Lähde: Zabmilenko: Orninalzofari: VectorrMW: Optimoitu, MultiLang, Wikimedia Commons
Kaavio, joka näyttää erot liuoksen, suspension ja saostumisen välillä, jotka muodostavat sakan ja supernatantin. Lähde: Zabmilenko: Orninalzofari: VectorrMW: Optimoitu, MultiLang, Wikimedia Commons Mitkä ovat tekijät, jotka vaikuttavat liukoisuuteen?
Pää- liukoisuuteen vaikuttavat tekijät Ne ovat napaisuus, yhteisen ionin, lämpötilan, paineen, liuenneen luonteen ja mekaanisten tekijöiden vaikutus. Liukoisuus on kiinteän, nestemäisen tai kaasumaisen kemikaalin kyky liuottaa liuottimeen (yleensä neste) ja muodostaa liuos.
Aineen liukoisuus riippuu pohjimmiltaan käytetystä liuottimesta sekä lämpötilasta ja paineesta. Aineen liukoisuus tietyssä liuottimessa mitataan tyydyttyneen liuoksen konsentraatiolla.
Liuosta pidetään tyydyttyneinä, kun ylimääräisen liuenneen aineen lisääminen ei enää lisää liuoksen pitoisuutta.
Liukoisuuden aste vaihtelee suuresti aineista riippuen, äärettömän liukoisesta (täysin sekoittava), kuten vedessä oleva etanol. Termi "liukenematon" koskee usein vähän liukoisia yhdisteitä.
Tietyt aineet ovat liukenevia kaikissa mittasuhteissa tietyn liuottimen kanssa, kuten etanoli vedessä. Tämä ominaisuus tunnetaan nimellä sekoittuvuus.
Erilaisissa olosuhteissa tasapainon liukoisuus voidaan ylittää liuoksen, jota kutsutaan ylikyllästetyksi.
Tärkeimmät liukoisuuteen vaikuttavat tekijät
1. Vastakkaisuus
Useimmissa tapauksissa liuenneita liuottimia liuottimissa, joilla on samanlainen napaisuus. Kemistit käyttävät suosittua aforismia kuvaamaan tätä liuenneiden aineiden ja liuottimien ominaisuuksia: "Samankaltainen liukenee samanlainen".
Ei -polaariset liuentuotteet eivät liukene polaarisiin liuottimiin ja päinvastoin.
2. Yleinen ionikuva
Yleinen ionivaikutus on termi, joka kuvaa ionisen yhdisteen liukoisuuden vähenemistä, kun suola sisältää ionin, joka on jo olemassa kemiallisessa tasapainossa.
Tämän vaikutuksen selitetään parhaiten Le Châtelierin periaatteella. Kuvittele, jos yhdiste kalsiumsulfaatti liukenee hieman, tapaus4, Se lisätään veteen. Tuloksena olevan kemiallisen tasapainon netto -ioninen yhtälö on seuraava:
Tapaus4 (s) ⇌ca2+(aq)+SO42− (aq)
Kalsiumsulfaatti on liukenevaa. Tasapainossa suurin osa kalsiumista ja sulfaatista on kiinteästi kalsiumsulfaattia.
Se voi palvella sinua: Iarhydric Acid (HI): rakenne, ominaisuudet ja käytötOletetaan, että ioninen yhdiste liukoinen kuparisulfaatti (CuO4) Se lisättiin liuokseen. Kuparisulfaatti on liukoinen. Siksi sen ainoa tärkeä vaikutus netto -ioniyhtälöön on enemmän sulfaatti -ionien lisääminen (niin42--A.
Cuso4 (s) ⇌cu2+(aq)+so42− (aq)
Kuparisulfaatin dissosioituneita sulfaatti -ioneja on jo läsnä (yleinen a) seoksessa kalsiumsulfaatin pienestä dissosiaatiosta.
Siksi tämä sulfaatti -ionien lisääminen korostaa aiemmin vakiintunutta tasapainoa.
Le Catelierin periaate määrää, että tasapainotuotteen tällä puolella olevat lisäponnistelut johtavat tasapainon muutokseen reagenssien puolelle tämän uuden jännityksen lievittämiseksi.
Reagoivan puolen muutoksen vuoksi liukoinen kalsiumsulfaattiliukoisuus vähenee edelleen.
3. Lämpötila
Lämpötilalla on suora vaikutus liukoisuuteen. Useimpien ionisten kiinteiden aineiden lämpötilan nousu lisää nopeutta, jolla liuos voidaan tehdä.
Lämpötilan noustessa kiinteät hiukkaset liikkuvat nopeammin, mikä lisää mahdollisuuksia olla vuorovaikutuksessa enemmän liuotinhiukkasia. Tämä johtaa nopeuden lisääntymiseen, jolla liuos tapahtuu.
Lämpötila voi myös lisätä liuenneen liuenneen aineen määrää. Yleisesti ottaen lämpötilan noustessa liukenevat hiukkaset liukenevat.
Esimerkiksi, kun sokeria lisätään veteen, se on helppo tapa tehdä ratkaisu. Kun liuosta lämmitetään ja sokeria lisätään edelleen, havaitaan, että suuria määriä sokeria voidaan lisätä, kun lämpötila edelleen nousee.
Syy siihen, että tämä tapahtuu, on, että lämpötilan noustessa molekyylien väliset voimat voidaan rikkoa helpommin, mikä mahdollistaa liuottimen hiukkasten houkuttelemisen enemmän.
Voi palvella sinua: Magnesium: historia, rakenne, ominaisuudet, reaktiot, käyttötarkoituksetOn kuitenkin muita esimerkkejä, joissa lämpötilan nousulla on hyvin vähän vaikutusta liuenneen liuenneen aineen määrään.
Pöytäsuola on hyvä esimerkki: Voit liuottaa melkein saman määrän pöytäsuolaa jääveteen kuin kiehuvassa vedessä.
Kaikille kaasuille, kun lämpötila nousee, liukoisuus laskee. Kineettinen molekyyliteoria voidaan käyttää selittämään tämä ilmiö.
Lämpötilan noustessa kaasumolekyylit liikkuvat nopeammin ja kykenevät välttämään nestettä. Kaasun liukoisuus vähenee sitten.
4. Paine
Neljäs tekijä, paine, vaikuttaa nesteen kaasun liukoisuuteen, mutta ei koskaan kiinteään aineeseen, joka liukenee nesteeseen.
Kun paine kohdistetaan kaasulle, joka on liuottimen pinnan yläpuolella, kaasu siirtyy liuottimeen ja vie joitain liuotinhiukkasten välisiä tiloja.
Hyvä esimerkki on hiilihapollinen sooda. Paine kohdistetaan soodan voima -molekyyleihin. Päinvastoin on myös totta. Kun kaasun paine laskee, myös kaasun liukoisuus vähenee.
Kun soodajuoman juoma aukeaa, soodan paine lasketaan, joten kaasu alkaa heti päästä pois liuoksesta.
Sodaan varastoitu hiilidioksidi vapautuu, ja voit nähdä porrastuksen nesteen pinnalla. Jos avoin soodasu.
Tämä kaasun painekerroin ilmaistaan Henryn laissa. Henryn laissa todetaan, että tietyssä lämpötilassa nesteen kaasun liukoisuus on verrannollinen nesteen kaasun osittaiseen paineeseen.
Voi palvella sinua: Normaalit ratkaisut: Konsepti, valmistelu, esimerkitEsimerkki Henryn laista tuotetaan sukelluksessa. Kun henkilö uppoutuu syvään veteen, paine nousee ja enemmän kaasuja liukenee vereen.
Kun se nousee syvästä vedestä, sukeltajan on palattava pintaan erittäin hitaasti, jotta kaikki liuenneen kaasut voivat poistua verestä hyvin hitaasti.
Jos henkilö nousee liian nopeasti, lääketieteellinen hätätilanne voi tapahtua kaasujen takia, jotka tulevat verestä liian nopeasti.
5. Liuenneen aineen luonne
Liuenneen aineen ja liuottimen luonne sekä muiden kemiallisten yhdisteiden läsnäolo liuoksessa vaikuttavat liukoisuuteen.
Esimerkiksi, voit liuottaa suuremman määrän sokeria veteen, joka tulee veteen. Tässä tapauksessa sanotaan, että sokeri on liukoisempi.
Vedessä oleva etanoli on täysin liukoinen toistensa kanssa. Tässä nimenomaisessa tapauksessa liuotin on yhdiste, joka on suurempi määrä.
Liuenneen aineen koko on myös tärkeä tekijä. Mitä suuremmat liuenneen aineen molekyylit, sitä suurempi sen molekyylipaino ja koko. Liuotinmolekyylien on vaikeampaa ympäröimään suurempia molekyylejä.
Jos kaikki edellä mainitut tekijät suljetaan pois, voidaan havaita yleinen sääntö, että suurimmat hiukkaset ovat yleensä vähemmän liukoisia.
Jos paine ja lämpötila ovat samat kuin saman polaarisuuden kahden liuenneen aineen välillä, pienemmillä hiukkasilla on yleensä liukoisempi.
6. Mekaaniset tekijät
Päinvastoin kuin liuosnopeus, joka riippuu pääasiassa lämpötilasta, uudelleenkiteyttämisenopeus riippuu kiteisen verkon pinnalla olevasta liuenneen aineen pitoisuudesta, joka suositaan, kun liuos on liikkumaton.
Siksi liuoksen levottomuus välttää tämän kertymisen, maksimoimalla liuoksen.
Viitteet
- Liukoisuus. Rajoista toipunut.com.
- Liukoisuutta kärsivät tekijät. Toipunut CK12: sta.org.
- Kouluttaa verkossa (S.F.-A. Liukoisuutta kärsivät tekijät. Haettu liukoisuudesta.com.

