Hajautettu vaihe
- 3583
- 913
- Alonzo Kirlin
 Lähde: Gabriel Bolívar
Lähde: Gabriel Bolívar Mikä on hajautettu vaihe?
Se hajautettu vaihe Se on vähemmässä osassa dispersiossa ja koostuu hyvin pienistä hiukkasista aggregaateista. Samaan aikaan runsainta ja jatkuvaa vaihetta, jossa hiukkaset sijaitsevat. Esimerkki on vesi, jossa on sokeri, jossa dispergoitu vaihe olisi sokeri ja dispergoiva vesi.
Dispersiot luokitellaan dispergoituneen vaiheen muodostavien hiukkasten koon mukaan, jotta voidaan erottaa kolmen tyyppiset dispersiot: töykeät dispersiot, kolloidiset ratkaisut ja todelliset ratkaisut.
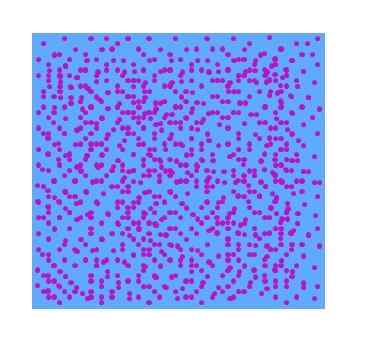
Ylemmässä kuvassa voidaan nähdä hypoteettinen dispergoitunut violetti hiukkasten dispergoitu vaihe vedessä. Seurauksena on, että lasi, joka on täynnä tätä dispersiota, ei osoita läpinäkyvyyttä näkyvälle valolle; Eli se näyttää violetista nestemäiseltä jogurtilta. Dispersiotyyppi vaihtelee näiden hiukkasten koosta riippuen.
Kun he ovat "hienoja" (10-7 m) Töykeistä dispersioista puhuu ja se voi sedimentin painovoiman vaikutuksesta; Kolloidiset ratkaisut, jos niiden koot vaihtelevat välillä 10-9 M ja 10-6 M, mikä tekee niistä näkyviä vain ultramikroskoopilla tai elektronisella mikroskoopilla; ja todelliset ratkaisut, jos niiden koot ovat alle 10-9 M, kyky ylittää kalvot.
Todelliset ratkaisut ovat siis kaikkia niitä, jotka tunnetaan yleisesti, kuten etikka tai sokerinen vesi.
Hajautetun vaiheen ominaisuudet
Ratkaisut muodostavat erityisen dispersiotapauksen, ja ne ovat erittäin kiinnostavia elävien olentojen fysiotakimica. Useimpia biologisia aineita, sekä solunsisäisiä että solunulkoisia, löytyy puhelujen dispersioiden muodossa.
Brownian liike ja Tyndall -vaikutus
Kolloidisten liuosten dispergoituneen vaiheen hiukkasilla on pieni koko, joka estää niiden sedimentaatiota. Lisäksi hiukkaset liikkuvat jatkuvasti satunnaisessa liikkeessä, törmäävät toisiinsa, mikä tekee sedimentaatiosta myös vaikeaa. Tämän tyyppinen liike tunnetaan nimellä Brownian.
Voi palvella sinua: Violet lasiDispergoituneiden faasihiukkasten suhteellisen suuren koon takia kolloidisilla liuoksilla on hämärä tai jopa läpinäkymätön ulkonäkö. Tämä johtuu siitä, että valo dispergoituu, kun kolloidi ylittää, ilmiö, joka tunnetaan nimellä Tyndall -efekti.
Heterogeenisyys
Kolloidiset järjestelmät ovat ei -homogeenisiä järjestelmiä, koska dispergoitu vaihe koostuu hiukkasista, joiden halkaisija on 10-9 M ja 10-6 m. Vaikka liuoshiukkaset ovat pienempiä, yleensä alle 10-9 m.
Kolloidisten liuosten dispergoituneen vaiheen hiukkaset voivat ylittää suodatinpaperin ja savisuodatin. Mutta ne eivät voi ylittää dialyysikalvoja, kuten sellofaania, kapillaarin endoteeliä ja kolodionia.
Joissakin tapauksissa dispergoituneen vaiheen muodostavat hiukkaset ovat proteiineja. Kun ne ovat vesifaasissa, proteiinit taittuvat jättäen hydrofiilisen osan ulkopuolelle suuremman vuorovaikutuksen kanssa veden kanssa, ion-dipolovoimien läpi tai vetysillajen muodostumisen myötä.
Proteiinit muodostavat retikulaarisen järjestelmän solujen sisällä, koska ne voivat ottaa osan dispergointiaineesta. Lisäksi proteiinien pinta liittyy pieniin molekyyleihin, jotka antavat pinnallisen sähkövarauksen, joka rajoittaa proteiinimolekyylien välistä vuorovaikutusta estäen niitä sedimentaation aiheuttamista hyytymistä, jotka aiheuttavat sedimentaatiota.
Vakaus
Kolloidit luokitellaan hajautetun vaiheen ja dispergointivaiheen välisen vetovoiman mukaan. Jos dispergointivaihe on nestemäinen, kolloidiset järjestelmät luokitellaan aurinkoiksi. Nämä on jaettu Deliphilosiin ja liofobeihin.
Se voi palvella sinua: kaliumkloraatti (kclo3)Liofiilikolloidit voivat muodostaa todellisia ratkaisuja ja ovat termodynaamisesti stabiileja. Toisaalta liofobit kolloidit voivat muodostaa kaksi vaihetta, koska ne ovat epävakaita, vaikkakin kineettisen näkökulmasta vakaita. Tämän avulla he voivat pysyä hajautetussa tilassa pitkään.
Hajautetut vaiheesimerkit
Sekä dispergointivaihe että dispergoitu vaihe voi esiintyä aineen kolmessa fysikaalisessa tilassa, toisin sanoen: kiinteä, nestemäinen tai kaasumainen.
Normaalisti jatkuva tai dispergointivaihe on nestemäisessä tilassa, mutta kolloidit, joiden komponentteja löytyy muista aineen aggregaation tiloista.
Dispergointivaiheen ja dispergoidun vaiheen yhdistämismahdollisuudet näissä fyysisissä tiloissa ovat yhdeksän.
Jokainen selitetään joillakin vastaavilla esimerkeillä.
- Kiinteät ratkaisut: Kun dispergointivaihe on kiinteä, se voidaan yhdistää dispergoituneeseen faasiin kiinteässä tilassa, muodostaen niin ns. Kiinteät liuokset.
Nämä ovat esimerkkejä näistä vuorovaikutuksista: monet terässeokset muiden metallien kanssa, jotkut värikkäitä helmiä, vahvistettu kumi, posliini ja pigmentoitu muovit.
- Vankat emulsiot: Kiinteän tilan dispergointivaihe voidaan yhdistää nestemäiseen dispergoituun faasiin, muodostaen niin kutsutut kiinteät emulsiot. Ne ovat esimerkkejä näistä vuorovaikutuksista: juusto, voi ja hyytelö.
- Kiinteät vaahdot: Dispergointivaihe kiinteänä aineena voidaan yhdistää dispergoituneeseen vaiheeseen kaasumaisessa tilassa, muodostaen niin keksittyjä kiinteitä vaahtoja. Esimerkkejä näistä vuorovaikutuksista ovat sieni, kumi, hohkakivi ja kumivaahto.
- Pohjat ja geelit: Dispergointivaihe nestemäisessä tilassa yhdistetään dispergoituneeseen faasiin kiinteässä tilassa, auringon ja geelien muodostaminen. Esimerkkejä näistä vuorovaikutuksista ovat magnesiamaito, maalaukset, muta ja Pudin.
Voi palvella sinua: iskunvaimentimet ratkaisut- Emulsiot: Dispergointivaihe nestemäisessä tilassa yhdistetään dispergoituneeseen faasiin myös nestemäisessä tilassa, tuottaen niin kutsutut emulsiot. Esimerkkejä näistä vuorovaikutuksista ovat maito, kasvovoide, salaattikastikkeet ja majoneesi.
- Vaahto: Dispergointivaihe nestemäisessä tilassa yhdistetään dispergoituneeseen faasiin kaasumaisessa tilassa, muodostaen vaahtoja. Esimerkkejä näistä vuorovaikutuksista ovat parranajovoide, kermavaahto ja olutvaahto.
- Kiinteät aerosolit: Dispergointivaihe kaasumaisessa tilassa yhdistetään dispergoituneeseen faasiin kiinteässä tilassa, aiheuttaen niin ns. Kiinteät aerosolit. Esimerkkejä näistä vuorovaikutuksista ovat savua, viruksia, ilmassa olevia materiaaleja, autojen pakoputkien lähettämiä materiaaleja.
- Nestemäiset aerosolit: Dispergointivaihe kaasumaisessa tilassa voidaan yhdistää dispergoituneeseen faasiin nestemäisessä tilassa, joka muodostaa niin päivättyjä nestekertoja. Esimerkkejä näistä vuorovaikutuksista ovat sumu, sumu ja kaste.
- Todelliset ratkaisut: Dispergointivaihe kaasumaisessa tilassa voidaan yhdistää kaasumaiseen vaiheeseen kaasumaisessa tilassa, muodostaen kaasumaiset seokset, jotka ovat todellisia liuoksia ja eivät kolloidisia järjestelmiä. Esimerkkejä näistä vuorovaikutuksista ovat valaistuksen ilma ja kaasu.
Viitteet
- Whitten, Davis, Peck & Stanley. Kemia (8.ª Ed.-A. Cengage -oppiminen.
- Toppr (S.F.-A. Kolloidien luokittelu. Toipunut: Toppr.com
- Jiménez Vargas, J ja MacArulla. J -. M. (1984). Fysiologinen fysikaalis, kuudes painos. Amerikanvälinen toimitus.
- Madhusha. Ero dispersioituneen vaiheen ja dispersion medumin välillä. Toipunut: Pediaa.com

