Fibronektiinirakenne ja toiminnot
- 3000
- 774
- Eddie Hackett
Se fibronektiini Se on glykoproteiiniluokka, joka kuuluu solunulkoiseen matriisiin. Tämäntyyppinen proteiini on yleensä vastuussa solukalvon sitomisesta tai yhdistämisestä ulkopuolelle löydettyihin kollageenikuituihin.
Nimi "fibronektiini" tulee sanasta, joka koostuu kahdesta sanasta latinaksi, ensimmäinen on "kuitu " mikä tarkoittaa kuitua tai filamenttia ja toista "Necter" Mikä tarkoittaa yhdistämistä, yhdistämistä, liittämistä tai flirttailua.
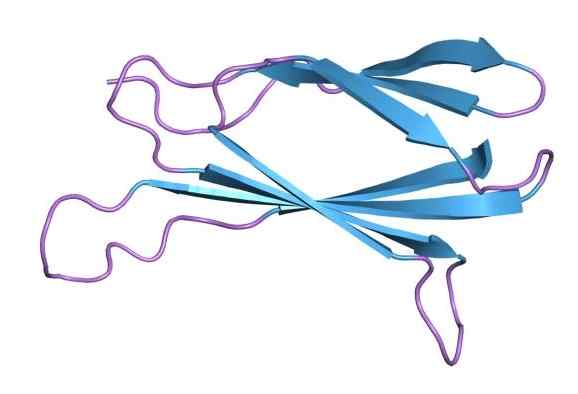
 Fibronektiinin molekyylirakenne (lähde: Jawahar Swaminathan ja MSD: n henkilökunta Euroopan bioinformatiikan instituutissa [julkinen alue] Wikimedia Commonsin kautta)
Fibronektiinin molekyylirakenne (lähde: Jawahar Swaminathan ja MSD: n henkilökunta Euroopan bioinformatiikan instituutissa [julkinen alue] Wikimedia Commonsin kautta) Fibronektiini visualisoitiin ensimmäisen kerran vuonna 1948 fibrinogeenin epäpuhtaudella, jonka Cohn Cold Etanolin fraktiointiprosessi on valmistettu. Tämä tunnistettiin ainutlaatuiseksi plasman glykoproteiiniksi, jolla oli kylmän liukenemattoman globuliinin ominaisuudet.
Tällä proteiinilla on korkea molekyylipaino ja se on liittynyt monenlaisiin toimintoihin kudosten sisällä. Niiden joukossa on solun ja solun välinen tarttuvuus, sytoskeleton, onkogeenisen transformaation, organisaatio, muun muassa.
Fibronektiini jakautuu monilla kehon osalla sen liukoisen muodon kautta veriplasmassa, aivo -selkäydinnesteessä, nivelnesteessä, amnioottisessa nesteessä, siemenesteessä, sylissä ja tulehduksellisissa eritteissä.
Tutkijat ovat ilmoittaneet, että fibronektiinin plasmapitoisuudet nousevat, kun raskaana olevat naiset kärsivät pre -plalassiasta. Siksi asiantuntijat ovat sisällyttäneet tämän fibronektiinikonsentraation lisääntymisen diagnosoimaan potilaat sanoman olosuhteet.
[TOC]
Rakenne
Fibronektiinit ovat suuria glykoproteiineja, joiden molekyylipaino on noin 440 kDa. Ne koostuvat noin 2.300 aminohappoa, jotka edustavat 95% proteiinista, koska muut 5% ovat hiilihydraatteja.
Se voi palvella sinua: Enterokromofines -solut: Histologia, toiminnot, sairaudetProteiinin genomisella ja transkriptillisellä sekvenssillä (lähettiläällä RNA) suoritetut erilaiset analyysit ovat osoittaneet, että tämä koostuu kolmesta toistuvien homologisten sekvenssien lohkoista, joiden pituudet ovat 45, 60 ja 90.
Kolme sekvenssityyppiä käsittää yli 90% fibronektiinien kokonaisrakenteesta. Tyypin I ja II homologiset sekvenssit ovat silmukoita yhdistyneinä toistensa kanssa disulfidisiltojen avulla. Nämä silmukot sisältävät vastaavasti 45 ja 60 aminohappojätteitä.
Tyypin III homologiset sekvenssit vastaavat 90 lineaarisessa aminohappoa ja ilman disulfuriltoja. Joillakin homologisten tyypin III sekvenssien sisäisistä aminohapoista on kuitenkin vapaita sulfidiryhmiä (R-S-H).
Kolme homologista sekvenssiä taittuvat ja järjestävät itsensä enemmän tai vähemmän lineaariseen matriisiin muodostaen kaksi "did -aseita" melkein identtisiä proteiinialayksiköitä. Kahden alayksikön väliset erot johtuvat transkriptiivien kypsymistapahtumien jälkeisistä tapahtumista.
Fibronektiinit voidaan yleensä havaita kahdella tavalla. Avoin muoto, jota havaitaan, kun se on kerrostettu kalvon pinnalle ja jotka ovat valmiita yhdistämään jonkin muun solun ulkokomponentin. Tätä muotoa havaitaan vain elektronisella mikroskopialla.
Toinen tapa voidaan nähdä fysiologisissa ratkaisuissa. Kunkin käsivarren päät tai laajennus taivutetaan kohti proteiinin keskustaa, liittymällä kollageenin sitoutumiskohtien karboksyylipäiden läpi. Tällä tavoin proteiinilla on globaali ulkonäkö.
"Moniadheesion" domeenit ja ominaisuudet
Freibonektiini Multiadheesio -ominaisuudet ovat peräisin eri domeenien läsnäolosta, joilla on korkeat affiniteettiarvot eri substraateille ja proteiineille.
Voi palvella sinua: Membraanireseptorit: toiminnot, tyypit, miten ne toimivat"Dimérica Arms" voidaan jakaa 7 erilaiseen funktionaaliseen alueeseen. Nämä luokitellaan sen substraatin tai verkkotunnuksen mukaan, johon jokainen liittyy. Esimerkiksi: Domeeni 1 ja domeeni 8 ovat liiton domeeneja fibriiniproteiinille.
Domeenilla 2 on kollageenin sitoutumisominaisuudet, domeeni 6 on solujen tarttumisen alue, ts. Se antaa sen ankkuroida melkein missä tahansa solujen kalvossa tai ulkopinnassa. Verkkotunnusten 3 ja 5 toiminnot ovat edelleen tuntemattomia tänään.
Domeenissa 9 proteiinin karboksyyli- tai C-terminaalinen pää sijaitsee. MOM-domeenin 6 solujen tarttumisalueilla on tripéptidi, joka muodostuu arginiini-glysiini-asparagiiniaminohapposekvenssistä (Arg-Gly-Asp).
Tämän tript jakavat useita proteiineja, kuten kollageeni ja integriini. Sama on minimirakenne, jota vaaditaan fibronektiinien ja integriinien plasmamembraanin tunnistamiseen.
Fibronektiini, kun se on pallo muodossaan, edustaa liukoista ja vapaata muotoa veressä. Solupinnoilla ja solunulkoisessa matriisissa se on kuitenkin "avoimessa", jäykässä ja liukenemattomassa muodossa.
Funktiot
Jotkut prosesseista, joissa fibronektiinien osallistuminen ovat solun solujen yhdistäminen, liitoskohde, liitäntä tai solujen tarttuminen plasmaan tai peruskalvoihin, verihyytymien stabilointiin ja haavan paranemiseen.
Solut tarttuvat tiettyyn kohtaan fibronektiinissä vastaanottavan proteiinin kautta, joka tunnetaan nimellä "integriini". Tämä proteiini ylittää plasmamembraanin solun sisäpuolelle.
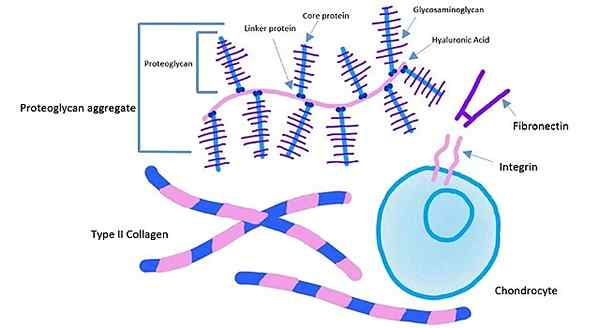 Rustokudoksen solunulkoisen matriisin komponentit (lähde: Kassidy Veasaw [CC BY-SA 4.0 (https: // creativecommons.Org/lisenssit/by-SA/4.0)] Wikimedia Commonsin kautta)
Rustokudoksen solunulkoisen matriisin komponentit (lähde: Kassidy Veasaw [CC BY-SA 4.0 (https: // creativecommons.Org/lisenssit/by-SA/4.0)] Wikimedia Commonsin kautta) Integriinien solunulkoinen domeeni sitoutuu fibronektiiniin, kun taas integriinien solunsisäinen domeeni on kiinnitetty aktiinifilamenteihin. Tämäntyyppisen ankkurin avulla voit siirtää solunulkoisessa matriisissa syntyneen jännityksen solujen sytoskeletoniin.
Se voi palvella sinua: Smozyme: Ominaisuudet, rakenne, toiminnotFibronektinat osallistuvat haavan paranemisprosessiin. Nämä, liukoisessa muodossaan, talletetaan haavan vieressä oleviin kollageenikuituihin auttaen fagosyyttien, fibroblastien ja solujen lisääntymistä avoimessa haavassa.
Todellinen paranemisprosessi alkaa, kun fibroblastit "kääntävät" fibronektiiniverkkoa. Tämä verkko toimii eräänlaisena telineenä tai tukena uusille kollageenikuituille, jotka on talletettu, sulfaatti heparán, proteoglican.
Fibronektiini osallistuu myös epidermaalisten solujen liikkeeseen, koska rakeisen kudoksen kautta se auttaa kudoksissa sijaitsevan orvaskeden alla olevan peruskalvon uudelleen järjestämisessä, mikä auttaa tapahtumaan keratinisointia.
Kaikilla fibronektiineillä on välttämättömiä funktioita kaikille soluille; He osallistuvat niin monimuotoisiin prosesseihin kuin muuttoliike ja solujen erilaistuminen, homeostaasi, haavan parantava fagosytoosi, muun muassa.
Viitteet
- Conde-agudelo, a., Romero, r., & Roberts, J. M. (2015). Testit preeklampsian ennustamiseksi. Chesleyn verenpainetaudissa raskauden aikana (PP. 221-251). Akateeminen lehdistö.
- Farfán, J. -Lla. Lens., Tovar, H. B -. S., kävelymatka, m. D -d. R -. G., & Guevara, c. G. (2011). Sikiön fibronektiini ja kohdunkaulan pituus ennenaikaisen synnytyksen varhaisina ennustajina. Meksikon gynekologia ja synnytys, 79 (06), 337-343.
- Feisti, e., & Hipe, f. (2014). Fibronektiini -auto -vasta -aineet. Auto -vasta -aineissa (PP. 327-331). Elsevier.
- Letourneau, p. (2009). Aksonaalinen polunpeite: matriisirooli solunulkoinen. Neurotieteen tietosanakirja, 1, 1139-1145.
- Pankov, R., & Yamada, K. M. (2002). Fibronektiini yhdellä silmäyksellä. Journal of Cell Science, 115 (20), 3861-3863.
- Proctor, R. -Lla. (1987). Fibronektiini: Lyhyt yleiskatsaus sen rakenteesta, toiminnasta ja fysiologiasta. Arvostelut tartunta helppous, 9 (lisäaine_4), S317-S321.
- « Condroblasts -ominaisuudet ja toiminnot
- Topo Grillo -ominaisuudet, elinympäristö, jakautuminen, plassit, ohjaus »

