Välihankojen rakenne, tyypit, toiminnot
- 1934
- 177
- Juan Breitenberg V
Se välituotteet, Tunnetaan myös kirjallisuudessa nimellä "ifs" (englanniksi Välituotteet), ovat liukenemattomien sytosolisten kuituproteiinien perhe, jota on läsnä kaikissa monisoluisissa eukaryoottisoluissa.
Ne ovat osa sytoskeletonia, joka on solunsisäinen rihmukohta, joka on pääasiassa vastuussa solurakenteen tuesta sekä erilaisista aineenvaihdunta- ja fysiologisista prosesseista, kuten vesikkelien kuljetuksesta, liikkumisesta ja solujen siirtymisestä jne.
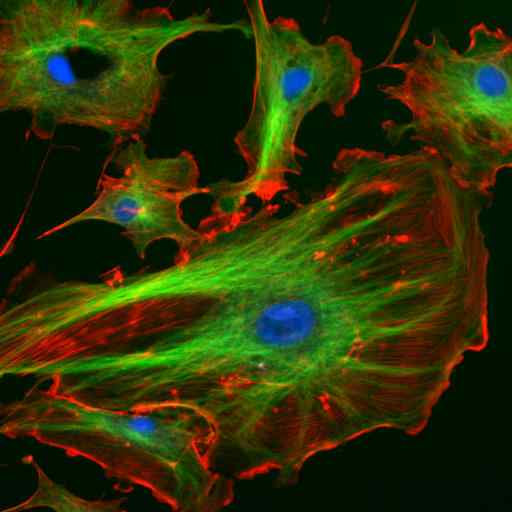
 Astrosyyttien välifilamentin kahden proteiinin (Vimenina ja GFAP) kahden proteiinin mikroskopia immunofluoresenssi (lähde: Gerryhaw [CC BY-SA 3.0 (https: // creativecommons.Org/lisenssit/by-SA/3.0)] Wikimedia Commonsin kautta)
Astrosyyttien välifilamentin kahden proteiinin (Vimenina ja GFAP) kahden proteiinin mikroskopia immunofluoresenssi (lähde: Gerryhaw [CC BY-SA 3.0 (https: // creativecommons.Org/lisenssit/by-SA/3.0)] Wikimedia Commonsin kautta) Yhdessä mikrotubulusten ja mikrofilamenttien kanssa välituotteet osallistuvat solunsisäisten organelien alueelliseen organisointiin, endosytoosi- ja eksosytoosiprosesseissa sekä myös solujen jakautumis- ja solujen välisessä viestinnässä.
Ensimmäiset tutkitut ja kuvattujen välituotteiden filamentit olivat kerainit, yksi ensimmäisistä proteiinien tyypeistä, joiden rakennetta analysoitiin x -diffraktiolla 1930 -luvulla.
Lasaridit kuitenkin esittelivät välitieteellisten filamenttien käsitteen 1980 -luvulla, jotka kuvasivat niitä "solutilan mekaanisiksi integraattoreiksi", joille on ominaista heidän liukenemattomuus ja kykynsä uudelleensuunnitteluun uudelleen In vitro Sen denaturoinnin jälkeen.
Monia kirjoittajia pidetään eläinsolujen stressin "tyyny" -elementteinä, koska ne ovat joustavampia filamentteja kuin mikrotubulukset ja mikrofilamentit. Niitä ei vain löydy sytoskeletonista, mutta ne ovat myös osa nukleoesquelettoa.
Toisin kuin sytoskeletonin kuitumaiset komponentit, välituotteiden filamentit eivät osallistu suoraan solujen liikkuvuusprosesseihin, vaan työskentelevät solujen rakenteellisessa ylläpidossa ja mekaanisessa resistanssissa.
[TOC]
Rakenne
 Lähde: http: // rsb.Tiedot.NIH.Gov/ij/kuvat/[julkinen alue]
Lähde: http: // rsb.Tiedot.NIH.Gov/ij/kuvat/[julkinen alue] Välitieteellisten filamenttien halkaisija on likimääräinen 10 nm, rakenteelliset ominaisuudet, joilla ne on nimetty, koska niiden koko on koon välillä, jotka vastaavat myosiini- ja aktiinifilamentteja, jotka ovat vastaavasti noin 25 nm ja 7 nm.
Ne eroavat rakenteellisesti kahdesta muusta sytoskeleton-filamenteista, jotka ovat globaaleja proteiinipolymeerejä, joissa niiden ainesosat ovat erilaisia a-helikoidisia kuituproteiineja, jotka on ryhmitelty toisiinsa muodostamaan rakenteita köyden tai köyden muodossa.
Kaikilla välituotteiden proteiineilla on samanlainen molekyylin organisaatio, joka koostuu α-helikidisesta tai ”köyden” domeenista, jolla on erilaisia määriä "kelan muotoilijoiden" segmenttejä samankokoisia.
Tätä kierteistä domeenia reunustaa ei-terminaalinen "pää" ja ei-hypoidinen "häntä" C-terminaalisessa päässä, ja molemmat vaihtelevat sekä koko- että aminohapposekvenssissä.
Näiden kahden ääripään sekvenssin sisällä ovat konsensussyyt, jotka ovat yleisiä kuuden tyyppiselle tunnetulle välitieteelliselle filamentille.
Selkärankaisilla välituotteiden sytosolisten filamenttien proteiinin ”köysi” -domeenilla on noin 310 aminohappojätettä, kun taas selkärangattomien ja ydinlaminaatin sytosoliset proteiinit ovat pituudeltaan noin 350 aminohappoa.
Voi palvella sinua: Matelijat: Mitkä ovat, ominaisuudet, luokittelu, lisääntyminenKokoonpano
Välitieteelliset filamentit ovat "itsekokoonpano" -rakenteita, joilla ei ole entsymaattista aktiivisuutta, joka myös erottaa ne sytoskeletaalisista vastineistaan (mikrotubulukset ja mikrofilamentit).
Nämä rakenteet kootaan alun perin rihmamahdokkaiden proteiinien tetrameereiksi, jotka käsittävät ne vain monovordenttien kationien vaikutuksesta.
Nämä tetrameerit ovat 62 nm pitkiä ja niiden monomeerit liittyvät toisiinsa sivusuunnassa "pituusyksiköiden" muodostamiseksi (ufl, englanninkielinen Yksikköhuone), Mitä kutsutaan kokoonpanon vaiheeksi 1, joka tapahtuu hyvin nopeasti.
UFL: t ovat pitkien filamenttien esiasteita, ja koska ne muodostavat dimeerit sitovat toisiaan antiparalleissa ja porrastetulla tavalla, näillä yksiköillä on keskusalue, jolla on kaksi reunustavaa domeenia, joiden läpi pidentymisen vaiheet 2, missä pitkittäisliitto Muista UFL: istä annetaan.
Kokoonpanon vaiheena 3 kutsutaan filamenttien halkaisijan säteittäistä tiivistämistä, joka tuottaa halkaisijaltaan kypsät välituotteet, jotka ovat enemmän tai vähemmän 10 nm.
Funktiot
Välitieteellisten filamenttien toiminnot riippuvat huomattavasti harkittujen solutyypistä, ja eläinten (mukaan lukien ihmiset) tapauksessa niiden ilmentymistä säädetään kudosspesifisellä tavalla, joten se riippuu myös kudostyypistä kuin alla opiskelu.
Epiteelia, lihaksia, mesenkymaalisia ja glialeja ja neuroneja on erityyppisiä filamentteja, erikoistuneet niiden solujen toiminnan mukaan, joihin ne kuuluvat.
Näiden toimintojen joukossa tärkeimmät ovat solujen rakenteellinen ylläpito ja resistenssi erilaisille mekaanisille stressille, koska näillä rakenteilla on jonkin verran joustavuutta, joka antaa niiden mahdollisuuden vaimentaa soluille asetettuja erityyppisiä voimia.
Välitieteellisten filamenttien tyypit
Väestöfilamentteja muodostavat proteiinit kuuluvat suureen ja heterogeeniseen rihmukalaisten proteiinien perheeseen, jotka ovat kemiallisesti erilaisia, mutta jotka erotetaan kuudessa luokassa sekvenssien homologian mukaan (I, II, III, IV, V ja VI).
Vaikka se ei ole kovin yleinen, erityyppiset solut, hyvin erityisissä olosuhteissa (kehitys, solujen muutos, kasvu jne.) He voivat ekspressoida useamman kuin yhden luokan välituotteita muodostavia proteiineja
Välitieteellisten filamenttien I ja II: happo- ja emäksiset keratiinit
Keratiinit edustavat suurinta osaa välifilamenttien proteiineista ja ihmisillä nämä edustavat yli kolme neljäsosaa välituotteiden filamenteista.
Heillä on molekyylipainot, jotka vaihtelevat välillä 40 - 70 kDa ja eroavat muista välituotteellisista filamenttiproteiineista johtuen niiden korkeasta pitoisuudesta glysiinissä ja seriinissä.
Voi palvella sinua: Hedgehogs: Ominaisuudet, elinympäristö, lisääntyminen, ruokaNe tunnetaan happona ja emäksisinä kerainina isoelektrisissä pisteissään, jotka ovat välillä 4.9 ja 5.4 happamille keratiineille ja välillä 6.1 ja 7.8 perusasioista.
Näissä kahdessa luokassa noin 30 proteiinia on kuvattu ja ne ovat läsnä erityisesti epiteelisoluissa, joissa molemmat proteiinin tyypit "kopolimerisoitu" ja muodostavat yhdistefilamentteja.
Monet väliaikaisten filamenttien tapaukset löytyvät rakenteista, kuten hiuksista, kynsistä, sarvista, piikistä ja kynnistä, kun taas luokka II ovat runsaimmin sytosolissa.
Välitieteellisten filamenttien luokka III: Demine/vimentiinityyppiset proteiinit
Falls on 53 kDa: n happama proteiini, jolla sen fosforylaatiosta riippuen on erilaisia variantteja.
Jotkut kirjoittajat ovat myös kutsuneet filamentteja putoamisesta "lihasvälitieteellisiksi filamenteiksi", koska niiden läsnäolo on melko rajoitettu, vaikka pieninä määrinä kaikentyyppiset lihassolut.
Myofibrillissä putoukset löytyvät linjasta Z, joten ajatellaan, että tämä proteiini myötävaikuttaa lihaskuitujen supistuviin toimintoihin työskennellessään myofibrillien ja plasmamembraanin liitossa.
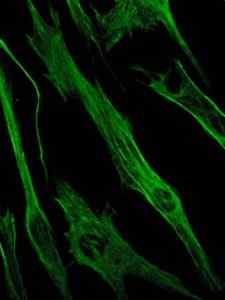 Valokuva vimentiiniproteiinin värjäyksestä, epiteeli- ja alkion solujen välituotteiden filamenttien proteiinista (lähde: Viktoriia Kosach [CC BY-SA 4.0 (https: // creativecommons.Org/lisenssit/by-SA/4.0)] Wikimedia Commonsin kautta)
Valokuva vimentiiniproteiinin värjäyksestä, epiteeli- ja alkion solujen välituotteiden filamenttien proteiinista (lähde: Viktoriia Kosach [CC BY-SA 4.0 (https: // creativecommons.Org/lisenssit/by-SA/4.0)] Wikimedia Commonsin kautta) Vimentin puolestaan on proteiini, joka on läsnä mesenkymaalisoluissa. Tämän proteiinin muodostamat välituotteet ovat joustavia ja on määritetty, että ne kestävät monia solusyklin aikana tapahtuvia konformaatiomuutoksia.
Sitä löytyy fibroblasteista, sileissä lihassoluissa, valkosoluissa ja muissa eläinten verenkiertoelimen soluissa.
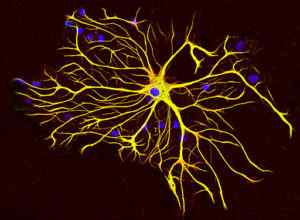
Välitieteellisten filamenttien luokka IV: neurofilamentousproteiinit
Tällaiset välituotteiden filamentit tunnetaan myös nimellä "neurofilamentit". Ne liittyvät usein mikrotubuluksiin, jotka myös muodostavat nämä rakenteet.
Selkärankaisten eläinten neurofilamentit on eristetty, ja se on 200, 150 ja 68 kDa In vitro.
Ne eroavat muista välitieteellisistä filamenteista, joissa heillä on sivuvarret, kuten ”liitteet”, jotka projisoidaan heidän reunastaan ja jotka toimivat viereisten filamenttien ja muiden rakenteiden välisessä vuorovaikutuksessa.
Glia -solut tuottavat erityisen tyyppisen välituotteiden filamentit, joita kutsutaan glia -välituotteiden filamenteiksi, jotka eroavat rakenteellisesti neurofilamenteista, koska ne koostuvat yhdestä 51 kDa.
Välitieteellisten filamenttien luokka V: Ydinlamina -filamentit
Kaikki nukleoeSfelettoa osat ovat tosiasiallisesti välituoteproteiineja. Näiden välillä on 60 - 75 kDa molekyylipaino ja ne löytyvät kaikkien eukaryoottisolujen ytimistä.
Voi palvella sinua: Trichuris trichiuraNe ovat välttämättömiä ydinalueiden sisäiselle organisaatiolle ja monille tämän olennaisen organellin toiminnoille eukaryootien olemassaololle.
VIIRJAVILLA VI: NESTINESIVIIVI
Tämäntyyppiset välituotteet painaavat enemmän tai vähemmän 200 kDa ja ovat pääosin keskushermoston kantasoluissa. Ne ilmenevät hermosolujen kehityksen aikana.
Aiheeseen liittyvät patologiat
Ihmisissä on useita sairauksia, jotka liittyvät välifilamenteihin.
Joissakin syöpätyypeissä, kuten esimerkiksi pahanlaatuisissa melanoomissa tai rintakarsinoomissa.
Kokeellisesti on osoitettu, että tämä ilmiö lisää syöpäsolujen muutto- ja invasiivista aktiivisuutta, jolla on tärkeitä vaikutuksia tälle tilaan ominaisia metastaattisia prosesseja.
Eriksson ja yhteistyökumppanit (2009) tarkastelevat erityyppisiä sairauksia ja niiden suhdetta spesifisiin mutaatioihin geeneissä, jotka osallistuvat kuuden välitieteellisten filamenttien muodostumiseen.
Kaksi keratiinityyppisiä geenimutaatioita koskevat sairaudet ovat bullas -epidermolyysi, epidermolyyttinen hyperkeratoosi, sarveiskalvon dystrofia, keratodermiat ja monet muut.
Tyypin III välituotteet ovat mukana lukuisissa kardiomyopatioissa ja erilaisissa lihasairauksissa, jotka liittyvät pääasiassa dystrofeihin. Lisäksi ne ovat vastuussa myös hallitsevista kaihista ja tietyntyyppisistä skleroosista.
Lukuisat neurologiset oireyhtymät ja häiriöt liittyvät tyypin IV filamenteihin, kuten Parkinson Parkinson. Samoin tyypin V ja VI -filamenttien geneettiset viat ovat vastuussa erilaisten autosomaalisten sairauksien kehityksestä ja liittyvät solun ytimen toimintaan.
Esimerkki näistä ovat mm. Hutchinson-Gilford Progeria -oireyhtymä, Emery-Dreifuss-lihasdystrofia.
Viitteet
- Anderton, b. H. (1981). Väliaikaiset filamles: homologisten rakenteiden perhe. Journal of Mercle Research and Cell Motility, 2(2), 141-166.
- Eriksson, J. JA., Pallari, h., Robert, D., Eriksson, J. JA., DeChat, t., Virniste, b.,… Goldman, R. D -d. (2009). Keskitason filamien esittely: löytöstä sairauteen. Journal of Clinical Invesiagation, 119(7), 1763-1771.
- Fuchs, e., & Weber, k. (1994). Väliaikaiset filamles: rakenne, dynamiikka, toiminta ja sairaus. Annu. Rev. Biokemia., 63, 345-382.
- Hendrix, M. J -. C., Seftor, E. -Lla., Chu, ja. W -., Trevor, k. T., & Seftor, R. JA. B -. (1996). Väliaikaisten fillamenttien rooli muuttoliikkeessä, hyökkäyksessä ja etäpesäkkeissä. Syöpä- ja etäpesäkkeet, viisitoista(4), 507-525.
- Herrmann, h., & Aebi, u. (2004). Välitieteelliset filamat: molekyylirakenne, kokoonpanomekanismi ja integraatio toiminnallisesti solunsisäisiin telineisiin. Biokemian vuosikatsaus, 73(1), 749-789.
- Herrmann, h., & Aebi, u. (2016). Väliaikaiset filamles: rakenne ja kokoonpano. Cold Spring Harbor -näkymät biologiassa, 8, 1-22.
- McLean, I., & Lane, b. (tuhatyhdeksänsataayhdeksänkymmentäviisi). Väliaikaiset filamorit diew. Nykyinen mielipide solubiologiassa, 7(1), 118-125.
- Steinert, P., & Roop, D. (1988). Välikalvojen molekyyli- ja solubiologia. Biokemian vuosikatsaus, 57(1), 593-625.
- Steinert, P., Jones, J., & Goldman, R. (1984). Välituotteet. Journal of Cell Biology, 99(1), 1-6.
- « Mahalaukun ominaisuudet, elinympäristö, lisääntyminen, ruoka
- Pehmeät moskeijan ominaisuudet, taksonomia, elinympäristö, käyttö »

