Fluori -historia, ominaisuudet, rakenne, hankkiminen, riskit, käyttää
- 2831
- 845
- Joshua Emmerich
Hän fluori Se on kemiallinen elementti, jota esitetään F -symbolilla ja pääryhmällä 17, johon halogeenit kuuluvat. Se erotetaan jaksollisen taulukon muiden elementtien yläpuolella reaktiivisimmasta ja elektronegatiivisimmasta; Reagoi melkein kaikkien atomien kanssa, joten se muodostaa lukemattomia suoloja ja organisaatioyhdisteitä.
Normaaliolosuhteissa se on vaaleankeltainen kaasu, joka voidaan sekoittaa kellertävän vihreään. Nestemäisessä tilassa, joka on esitetty alemmassa kuvassa, sen keltainen väri lisääntyy hiukan enemmän, mikä katoaa kokonaan, kun se jähmettyy jäätymispisteessä.
 Nestemäinen fluori koeputkessa. Lähde: Fulvio314 [CC BY-SA 3.0 (https: // creativecommons.Org/lisenssit/by-SA/3.0)]
Nestemäinen fluori koeputkessa. Lähde: Fulvio314 [CC BY-SA 3.0 (https: // creativecommons.Org/lisenssit/by-SA/3.0)] Se on sellainen reaktiivisuus, huolimatta sen kaasun haihtumisesta, joka pysyy kiinni maankuoressa; Varsinkin fluoriittimineraalin muodossa, joka tunnetaan violettikiteistään. Samoin sen reaktiivisuus tekee siitä potentiaalisesti vaarallisen aineen; reagoi voimakkaasti kaiken kanssa, mikä koskettaa ja palaa liekkeinä.
Monet sen johdetut tuotteet voivat kuitenkin olla vaarattomia ja jopa hyödyllisiä niiden sovelluksista riippuen. Esimerkiksi ioniseen tai mineraalimuotoon lisätty fluoridin suosituin käyttö (kuten fluoridisuolat) koostuu fluoridien hammaspastaten valmistuksesta, jotka auttavat suojaamaan hammaslääkettä.
Fluori esittää erityispiirteet, joita suuret määrät tai hapettumistilat voivat stabiloida monille muille elementeille. Mitä suurempi fluoriatomien lukumäärä, sitä reaktiivisempi yhdiste on (ellei se ole polymeeri). Samoin sen vaikutukset molekyylimatriisien kanssa lisääntyvät; parempaan tai huonompaan.
[TOC]
Historia
Fluoriitin käyttö
Vuonna 1530 saksalainen mineralogisti Georgius Agricola havaitsi, että Fluoresparin mineraalit voitaisiin käyttää metallinpuhdistuksessa. Fluorespar on toinen nimi fluoriittille, fluorin mineraalille, joka koostui kalsiumfluoridista (CAF2-A.
Fluorielementtiä ei ollut tuolloin löydetty ja fluoriitin "fluori" tuli latinalaisesta sanasta "flere", joka tarkoittaa "virtausta"; Siitä lähtien, mitä fluoresparit tai fluorite teki metallien kanssa: se auttoi heitä jättämään näytteen.
Fluorhohapon valmistus
Vuonna 1764 Andreas Sigismud Margraff hallitsi. Hapon vaikutuksella sulatettu lasi palautuu, joten lasi korvattiin metalleilla.
Se johtuu myös Carl Scheelesta vuonna 1771, hapon valmistelu samalla menetelmällä, jota seuraa Margraff. Vuonna 1809 ranskalainen tiedemies Andre-Marie Ampere ehdotti, että fluori- tai fluoriahappo oli yhdiste, joka muodostettiin vedyn ja uuden elementin kaltaisen elementin kanssa.
Tutkijat yrittivät eristää fluorifluoria käyttämällä fluoriahareahappoa pitkään; Mutta sen vaara eteni tässä suhteessa.
Humphry Davy, Joseph Louis Gay-Lussac ja Jacques Thénard saivat voimakasta kipua hengitettäessä vetyfluoria (fluoridihappo ilman vettä ja kaasumaisessa muodossa)). Samanlaisissa olosuhteissa tutkijat Paulin Louyet ja Jerome Nickles kuolivat myrkytyksellä.
Ranskalainen tutkija Edmond Fréme yritti luoda kuivaa fluorhoridihappoa vetyfluoridin toksisuuden välttämiseksi happamoittamalla kaliumbifluoridia (KHF2), Mutta elektrolyysin aikana sähkövirta ei johtanut.
Eristäytyminen
Vuonna 1860 englantilainen kemisti George Gore yritti. Kuitenkin tapahtui räjähdys yhdistämällä väkivaltaisesti vety fluoridilla. Gore katsoi räjähdyksen happivuotoon.
Vuonna 1886 ranskalainen kemisti Henri Moisson onnistui eristämään fluoridin ensimmäistä kertaa. Aikaisemmin Moissonin työ keskeytettiin neljä kertaa vetyfluoridin vakavan myrkytyksen vuoksi yrittäen samalla eristää elementin.
Moisson oli fony -opiskelija ja perustui hänen kokeisiinsa fluoridin eristämiseksi. Moisson, jota käytettiin elektrolyysissä kaliumfluoridin ja fluoriahaappahapon seos. Tuloksena oleva liuos johti anodiin kertyneen sähkön ja fluorin kaasun; toisin sanoen positiivisesti ladatussa elektrodissa.
Moisson käytti korroosio -resistenttejä laitteita, joissa elektrodit valmistettiin platina- ja iridiumseoksesta. Elektrolyysissä se käytti platinasäiliötä ja jäähdytti elektrolyyttistä liuosta lämpötilassa -23 ºF (-31 ºC).
Lopuksi, 26. kesäkuuta 1886, Henri Moisson onnistui eristämään fluoridin.
Kiinnostus fluoriin
Jonkin aikaa kiinnostus fluoridien tutkimiseen menetettiin. Manhattan -projektin kehittäminen atomipommin tuotantoa varten kuitenkin.
Amerikkalainen DuPont kehitti vuosina 1930–1940 fluoratut tuotteet, kuten klorofluoriharbonaatit (Freon-12), joita käytettiin kylmäaineena; ja polyterafluorietyleenimuovi, joka tunnetaan parhaiten nimellä Teflon. Tämä tuotti fluorintuotannon ja kulutuksen lisääntymisen.
Vuonna 1986 fluorin eristyksen vuosisadan ajan konferenssissa, amerikkalainen kemisti Karl tai. Christe esitti kemiallisen menetelmän fluoridin valmistukseen reaktiolla k: n välillä2Mnf6 ja SBF5.
Voi palvella sinua: polyvinyylialkoholiFysikaaliset ja kemialliset ominaisuudet
Ulkomuoto
Fluori on vaaleankeltainen kaasu. Nestemäisessä tilassa se on kirkkaankeltainen. Samaan aikaan kiinteä aine voi olla läpinäkymätön (alfa) tai läpinäkyvä (beeta).
Atominumero (z)
9.
Atomipaino
18 998 u.
Sulamispiste
-219,67 ºC.
Kiehumispiste
-188.11 ºC.
Tiheys
Huoneenlämpötilassa: 1 696 g/l.
Sulamispisteessä (neste): 1 505 g/ml.
Höyrystyslämpö
6,51 kJ/mol.
Molaarinen kalorikapasiteetti
31 j/(mol · k).
Höyrynpaine
58 K: n lämpötilassa on 986,92 ATM -höyrynpaine.
Lämmönjohtokyky
0,0277 w/(m · k)
Magneettinen järjestys
Diagneettinen
Haju
Mausteinen ja tunkeutuva ominaishaju, havaittavissa jopa 20 ppb.
Hapetusluvut
-1, joka vastaa fluoridianionia, F-.
Ionisaatioenergia
-Ensimmäinen: 1.681 kJ/mol
-Toiseksi: 3.374 kJ/mol
-Kolmas: 6.147 kJ/mol
Elektronegatiivisuus
3.98 Pauling -asteikolla.
Se on kemiallinen elementti, jolla on suurin elektronegatiivisuudet; toisin sanoen sillä on korkea affiniteetti niiden atomien elektronien suhteen, joihin se on linkitetty. Tämän vuoksi fluoriatomit tuottavat suuria dipolimomentteja molekyylin tietyillä alueilla.
Hänen elektronegatiivisuudellaan on myös toinen vaikutus: häneen kytketyt atomit menettävät niin paljon elektronista tiheyttä, että he alkavat hankkia positiivista kuormaa; Tämä on positiivinen hapettumisnumero. Mitä enemmän fluoriatomeja yhdisteessä, keskusatomilla on positiivisempi hapetusluku.
Esimerkiksi2 Hapen hapettumismäärä on +2 (tai2+F2-) UF: ssä6, Uraanilla on hapettumisnumero +6 (u6+F6-) Sama koskee rikkiä SF: ssä6 (S6+F6-) Ja lopuksi on AGF2, missä hopealla on jopa hapettumismäärä +2, epätavallinen.
Siksi elementit onnistuvat osallistumaan positiivisimpiin hapettumislukuihinsa, kun ne muodostavat yhdisteitä fluoridilla.
Hapettava aine
Fluori on tehokkain hapettava elementti, joten mikään aine ei kykene hapettamaan sitä; Ja tästä syystä hän ei ole luonteeltaan vapaa.
Reaktiivisuus
Fluori kykenee yhdistämään kaikkiin muihin elementteihin, paitsi heliumilla, neonilla ja argonilla. Se ei myöskään hyökkää makeaa terästä tai kuparia normaalissa lämpötiloissa. Reagoi väkivaltaisesti orgaanisten materiaalien, kuten kumin, puun ja kankaan kanssa.
Fluori voi reagoida jalokaasun ksenonin kanssa muodostaakseen ksenonin voimakkaan difluoruro -hapettimen, XEF2. Se reagoi myös vedyn kanssa halogenian, vetyfluoridin, HF: n muodostamiseksi. Vetyfluoridi puolestaan liuenntaan veteen kuuluisan fluoriahapon tuottamiseksi (Eat Glass).
Kasvavassa järjestyksessä luokiteltujen vesihapojen happamuus on:
HF < HCl < HBr < HI
Typpihappo reagoi fluoridin kanssa fluorinitraatin, FNO: n muodostamiseksi3. Samaan aikaan suolahappo reagoi voimakkaasti fluoridin kanssa muodostaakseen HF: n,2 ja clf3.
Elektroninen rakenne ja kokoonpano

Diatominen molekyyli
 Fluoridimolekyyli, jota edustaa avaruuden täyttömalli. Lähde: Gabriel Bolívar.
Fluoridimolekyyli, jota edustaa avaruuden täyttömalli. Lähde: Gabriel Bolívar. Fluoriatomilla perustilassa on seitsemän Valencian elektronia, jotka ovat Orbitals 2S: ssä ja 2p: n elektronisen kokoonpanon mukaan:
[He] 2s2 2 p5
Valencia Link -teoria (TEV) osoittaa, että kaksi fluoriatomia, F, on kovalenttisesti kytkettynä voidakseen suorittaa oktettinsa Valenciassa.
Tämä tapahtuu nopeasti, koska siitä tuskin puuttuu elektronia, jotta ne tulevat erolektroniseksi jalokaasulle; Ja sen atomit ovat hyvin pieniä, erittäin voimakas tehokas ydinkuorma, joka vaatii helposti ympäristöä.
Molekyyli f2 (Superior Image), on yksinkertainen kovalenttinen linkki, f-f. Stabiilisuudestaan huolimatta vapaisiin F -atomiin verrattuna, se on erittäin reaktiivinen molekyyli; Homonukleaarinen, apolaarinen ja innokas elektroneille. Siksi fluori, kuten f2, Se on erittäin myrkyllinen ja vaarallinen laji.
Koska f2 Se on apolaarinen, sen vuorovaikutukset riippuvat sen molekyylimassasta ja Lontoon dispersiovoimista. Jossain vaiheessa molempien F -atomien ympärillä olevan elektronisen pilven on muodostuttava ja se on oltava välitön dipoli, joka indusoi toisen viereisessä molekyylissä; niin että he ovat hitaasti ja heikkaita.
Nestemäinen ja kiinteä
Molekyyli f2 Se on hyvin pieni ja leviää avaruuteen suhteellisen nopeuden kanssa. Kaasufaasissaan sillä on vaaleankeltainen väri (joka voidaan sekoittaa kalkkivihreään). Kun lämpötila laskee -188 ºC: seen, dispersiovoimat tulevat tehokkaammiksi ja tekevät molekyyleistä f2 Koheesio riittävä nesteen määrittelemiseksi.
Nestemäinen fluori (ensimmäinen kuva) näyttää vieläkin keltaisemmalta kuin sen kaasu. Siinä molekyylit f2 Ne ovat lähempänä ja ovat vuorovaikutuksessa valon kanssa suuressa määrin. Mielenkiintoista on, että kun vääristynyt kuutiolasi on muodostettu fluorista -220 ºC: seen, väri haalistuu ja pysyy läpinäkyvänä kiinteänä aineena.
Voi palvella sinua: haarautuneet alkanitNyt kun M -molekyylit2 Ne ovat niin lähellä (mutta ilman heidän molekyylin kiertoa ei pysähdy), näyttää siltä, että heidän elektronit ansaitsevat jonkin verran vakautta ja siksi niiden elektroninen hyppy on liian suuri, jotta valo jopa on vuorovaikutuksessa lasin kanssa.
Kiteinen vaihe
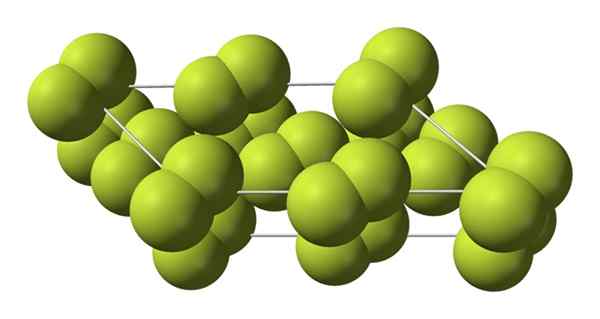
Tämä kuutiokide vastaa β -vaihetta (se ei ole alotrooppinen, koska se pysyy samana F2-A. Kun lämpötila laskee vielä enemmän, jopa -228 ºC: iin saakka, kiinteä fluori kärsii vaihesiirtymästä; Kuutiolasi muuttuu monokliiniseksi, a -faasiksi:
 Fluorin alfafaasin kiteinen rakenne. Lähde: Benjah-BMM27 [julkinen alue].
Fluorin alfafaasin kiteinen rakenne. Lähde: Benjah-BMM27 [julkinen alue]. Toisin kuin β-F2, Α-F2 on läpinäkymätön ja kova. Ehkä se johtuu siitä, että M -molekyylit2 Heillä ei enää ole sellaista vapautta kiertää kiinteissä asemissaan monokliinisissä kiteissä; missä he ovat vuorovaikutuksessa enemmän valon kanssa, mutta ilman elektroneja herättämättä (mikä selittäisi pinnallisesti heidän opasiteettinsa).
Α-F: n kiteinen rakenne2 Oli vaikea tutkia tavanomaisten X -rayn diffraktiomenetelmien avulla. Tämä johtuu siitä, että siirtyminen vaiheesta β on hyvin eksoterminen; Joten kristalli käytännössä hyödynnettiin, samalla kun se on vähän vuorovaikutuksessa säteilyn kanssa.
He viettivät noin viisikymmentä vuotta ennen saksalaisten tutkijoiden (Florian Kraus ja yhteistyökumppaneiden), salaista kokonaan α-F-rakenne2 Suuremmalla tarkkuudella neutronidiffraktiotekniikoiden ansiosta.
Missä se on ja saa
Fluori vie 24. maailmankaikkeuden yleisimmistä elementeistä. Maapallolla on kuitenkin massassa 13voima elementti, jonka pitoisuus on 950 ppm maankuoressa ja pitoisuus 1,3 ppm merivedessä.
Maaperällä on fluoripitoisuus välillä 150 - 400 ppm, ja joillakin maaperällä pitoisuus voi saavuttaa 1.000 ppm. Ilmakehän ilmassa sitä on läsnä pitoisuutena 0,6 ppb; Mutta se on rekisteröitynyt joihinkin kaupunkiin jopa 50 ppb.
Fluori saadaan pääasiassa kolmesta mineraalista: fluoriitti tai fluorispar (kahvi2), Fluorapatita [CA5(PO4-A3F] ja kreoli (na3Alf6-A.
Fluoriprosessointi
Kun kivet kerättiin fluoriitti mineraalilla, ne ovat ensisijaisen ja toissijaisen murskauksen alaisia. Toissijaisella murskauksella saadaan hyvin pienet kivipalat.
Sitten kalliofragmentit viedään pallomyllyyn pölyn vähentämistä varten. Vettä ja reagensseja lisätään tahnan muodostamiseksi, joka asetetaan vaahdotussäiliöön. Siinä injektoidaan paine kuplien muodostamiseksi, ja siten fluorite päätyy vesipitoiselle pinnalle.
Silikaatit ja karbonaatit ovat sedimenttejä, kun fluoriitti kerätään ja johtaa kuivausuuniin.
Kun fluoriitti on saatu, se reagoi rikkihappon kanssa vetyfluoridin tuottamiseksi:
Kahvila2 + H2Sw4 => 2 HF +tapausta4
Vetyfluoridielektrolyysi
Fluoridituotannossa noudatetaan joitain muutoksia, menetelmällä, jota Moisson käytti vuonna 1886.
Sulan kaliumfluoridin ja fluohydric -hapon seoksen elektrolyysi tehdään, molaarisella säteellä 1: 2,0 - 1: 2,2. Sulan suolalämpötila on 70 - 130 ºC.
Katodi koostuu monet- tai terässeoksesta, ja anodi on hiilen uudelleengrapia. Fluorintuotantoprosessi elektrolyysin aikana voidaan kaavioida seuraavasti:
2HF => H2 + F2
Vettä käytetään elektrolyysikammion jäähdyttämiseen, mutta lämpötilan on oltava elektrolyytin sulamispisteen yläpuolella jähmennyksen välttämiseksi. Elektrolyysissä tuotettu vety kerätään katodiin, kun taas fluoridi anodissa.
Isotoopit
Fluoridissa on 18 isotoopia, jotka ovat 19F ainoa vakaa isotooppi, jolla on 100% runsaus. Hän 18F: n puolen eläin on 109,77 minuuttia ja se on fluorin radioaktiivinen isotooppi, jolla on suurin puoli -elämä. Hän 18F sitä käytetään positronilähteenä.
Biologinen paperi
Fluorin metabolista aktiivisuutta nisäkkäissä tai ylemmissä kasveissa ei tunneta. Jotkut merikasvit ja sienet kuitenkin syntetisoivat monofluroasetaatin, myrkyllisen yhdisteen, joka käyttää suojaa tuhoamisen välttämiseksi.
Riskejä
Liiallinen fluorin kulutus on liitetty luun fluoroosiin aikuisilla ja lasten hammasfluoroosi sekä munuaisten toiminnan muutokset. Tästä syystä Yhdysvaltain kansanterveyspalvelu (PHS) ehdotti, että juomaveden fluoripitoisuuden ei tulisi olla suurempi kuin 0,7 mg/l.
Samaan aikaan Yhdysvaltojen ympäristösuojeluvirasto (EPA) totesi, että fluoridin pitoisuuden juomavedessä ei saisi olla suurempi kuin 4 mg/l, jotta vältetään luurankofluoroosi, jossa fluoridi kertyy luihin. Tämä voi aiheuttaa luun heikentymistä ja murtumia.
Fluori on liittynyt lisäkilpirauhanen vaurioihin, ja luusarakenteen kalsiumin väheneminen ja korkeat kalsiumpitoisuudet plasmassa.
Se voi palvella sinua: Elävä aine: Konsepti, ominaisuudet ja esimerkitYlimääräisestä fluorista johtuvien muutosten joukossa ovat seuraavat: hammasfluoroosi, luurankofluoroosi ja vauriot lisävarusteelle.
Hammasfluoroosi
Hammasfluoroosi esitetään pienillä raidoilla tai moottoripyörillä hammaskielessä. Alle 6 -vuotiaiden lasten ei pitäisi käyttää suuhuvia, jotka sisältävät fluoria.
Luuston fluoroosi
Luurankofluoroosissa voidaan diagnosoida kipu ja vauriot, samoin kuin nivelissä. Luu voi kovettua ja menettää joustavuuden, mikä lisää murtumien riskiä.
Sovellukset
Hammastahna
 Joitakin epäorgaanisia fluoridisuoloja käytetään lisäaineena hammaspastan formulaatiossa, jotka ovat osoittaneet, että ne auttavat suojaamaan hammaslääkettä. Lähde: Pxhere.
Joitakin epäorgaanisia fluoridisuoloja käytetään lisäaineena hammaspastan formulaatiossa, jotka ovat osoittaneet, että ne auttavat suojaamaan hammaslääkettä. Lähde: Pxhere. Aloitamme fluoridin käyttöosasta, jolla tunnetaan parhaiten: toimia monien hammaspastaten komponenttina. Tämä ei ole ainoa käyttö, jossa kontrasti sen molekyylin F välillä voidaan nähdä2, erittäin myrkyllinen ja vaarallinen, ja anionin f-, joka ympäristöstä riippuen voivat olla hyödyllisiä (vaikka joskus ei).
Kun syömme ruokaa, erityisesti makeisia, bakteerit heikentävät niitä lisäämällä syljen happamuutta. Sitten on kohta, jossa pH riittää hajottamaan ja demineralisoimaan hammaskaitaa; Hydroksiapatiitti tulee "alas".
Tässä prosessissa ionit f kuitenkin- vuorovaikutuksessa CA: n kanssa2+ fluorapatiittimatriisin muodostamiseksi; vakaampi ja kestävämpi kuin hydroksiapatiitti. Tai ainakin tämä on ehdotettu mekanismi, joka selittää hampaiden fluoridianionin vaikutuksen. On todennäköistä, että se on monimutkaisempi ja että pH: sta riippuen on hydroksiapatiitti-fluorapatiitti.
Nämä anionit f- Niitä on saatavana hammaspappeissa suoloissa; kuten: NAF, SNF2 (Kuuluisa Stine Fluoridi) ja NAPOF. F: n pitoisuus kuitenkin- Sen on oltava alhainen (alle 0,2%), koska muuten se aiheuttaa kielteisiä vaikutuksia kehoon.
Vesifluoraus
Hyvin samanlainen kuin hammaspastan kanssa, juomavesilähteisiin on lisätty fluoridisuoloja kariesin esiintymisen torjumiseksi niissä, jotka juovat. Pitoisuuden on silti oltava paljon alhaisempi (0,7 ppm). Tämä käytäntö on kuitenkin yleensä epäluotettavaa ja kiistanalaista, kuten mahdolliset syöpää aiheuttavat vaikutukset on annettu.
Hapettava aine
Kaasu f2 Se käyttäytyy kuin erittäin vahva hapettumisaine. Tämä saa monet yhdisteet järjestämään enemmän kuin happea ja lämmönlähdettä altistettaessa. Siksi sitä on käytetty rakettipolttoaineseoksissa, joissa ne voivat jopa korvata otsonin.
Polymeerit
Monissa käyttötarkoituksissa fluori -osuudet eivät johdu F: stä2 tai f-, mutta suoraan sen elektronegatiivisiin atomeihin, jotka muodostavat osan orgaanista yhdistettä. Siksi C-F-linkin ydin.
Rakenteesta riippuen polymeerit tai kuidut, joilla on C-F-sidokset, ovat yleensä hydrofobisia, joten ne eivät kastu tai vastustavat fluoriahapon hyökkäystä; Tai vielä parempaa, ne voivat olla erinomaisia sähköeristimiä ja hyödyllisiä materiaaleja, joiden kanssa valmistetaan esineitä, kuten putket ja liitokset. Teflon ja Navion ovat esimerkkejä näistä fluoratuista polymeereistä.
Apteekkarit
Fluoridin reaktiivisuutta kutsutaan sen käyttöön monien fluorin, orgaanisten tai epäorgaanisten yhdisteiden synteesiin. Orgaanisissa, erityisesti ne, joilla on farmakologisia vaikutuksia, korvaa yhden heidän heteroátomosista atomilla f kasvaa (positiivisesti tai negatiivisesti) sen vaikutusta biologiseen tavoitteeseensa.
Siksi lääketeollisuudessa joidenkin lääkkeiden modifiointi on aina pöydällä lisäämällä fluoriatomeja.
Hyvin samanlainen tapahtuu rikkakasvien torjunta -aineiden ja sienitautien kanssa. Niissä oleva fluori voi lisätä niiden vaikutusta ja tehokkuuttaan hyönteisiin ja sienten tuholaisiin.
Lasikierrys
Fluoriahappoa on käytetty aggressiivisuudestaan lasilla ja keramiikalla, näiden materiaalien ohuista ja herkistä kappaleista; Yleensä on tarkoitettu tietokoneiden mikrokomponenttien valmistukseen tai sähköisistä lamppuista.
Uraanin rikastuminen
Yksi perusfluoridin merkityksellisimmistä käytöistä on auttaa rikastuttamaan uraania 235TAI. Tätä varten uraanimineraalit liukenevat fluoriahapaan, tuottaen UF: n4. Tämä epäorgaaninen fluori reagoi sitten F: n kanssa2, Muuttua UF: ksi6 (235HUH HUH6 ja 238HUH HUH6-A.
Myöhemmin, ja kaasun sentrifugoinnin kautta 235HUH HUH6 Se erottuu jstk 238HUH HUH6 ja sitten hapettu ja varastoidaan ydinpolttoaineena.
Viitteet
- Shiver & Atkins. (2008). Epäorgaaninen kemia. (Neljäs painos). MC Graw Hill.
- KraMer Katrina. (2019). Frozen Fluorinin rakenne, joka on tarkistettu 50 vuoden kuluttua. Kuninkaallinen kemian yhdistys. Toipunut: ChemistryWorld.com
- Wikipedia. (2019). Fluori. Haettu: vuonna.Wikipedia.org
- Kansallinen bioteknologiatietojen keskus. (2019). Fluori. Pubchem -tietokanta. CID = 24524. Toipunut: Pubchem.NCBI.Nlm.NIH.Hallitus
- DR. Doug Stewart. (2019). Fluorielementit. Kemikooli. Toipunut: Chemicool.com
- Batul Nafisa Baxamusa. (21. helmikuuta 2018). Erittäin reaktiivisen fluorin yllättävän yleiset käyttötarkoitukset. Toipunut: Sciencestruck.com
- Paola Opazo Sáez. (4. helmikuuta 2019). Fluori hammastahnassa: Onko se hyvä vai huono terveydelle? Toipunut: Nacionfarma.com
- Karl Christe & Stefan Schneider. (8. toukokuuta 2019). Fluori: kemiallinen elementti. Encyclopædia britannica. Toipunut: Britannica.com
- Lentech b.V. (2019). Aikataulukko: happi. Toipunut: lentech.com
- Gagnon Steve. (S.F.-A. Elementtifluori. Jefferson Lab. Toipunut: Koulutus.JLAB.org
- American Cancer Society lääketieteellinen ja toimituksellinen sisältöryhmä. (28. heinäkuuta 2015). Vesifluoraus ja syöpäriski. Toipunut: syöpä.org
- « Tarkat tieteelliset ominaisuudet, mitä opiskelet, esimerkkejä
- Ei metallihistoriaa, ominaisuuksia, ryhmiä, »

