Ei metallihistoriaa, ominaisuuksia, ryhmiä,

- 971
- 35
- Louis Moen
Se ei metalleja Ne ovat ryhmä elementtejä, jotka sijaitsevat jaksollisen taulukon oikealla puolella, lukuun ottamatta vetyä, joka sijaitsee ryhmässä 1 (AI) yhdessä alkalimetallien kanssa. Jos haluat tietää mitä ne ovat, sinun on katsottava P -lohkon oikeaa yläkulmaa.
Ei -metalliatomit ovat suhteellisen pieniä ja niiden ulkoisella elektronisella kerroksella on kohonnut määrä elektroneja. Ei -metallisia elementtejä, kiinteitä aineita, nesteitä ja kaasuja löytyy; Vaikka ne ovat enimmäkseen kaasumaisessa tilassa, monet heistä rikastuttavat ilmakehää.
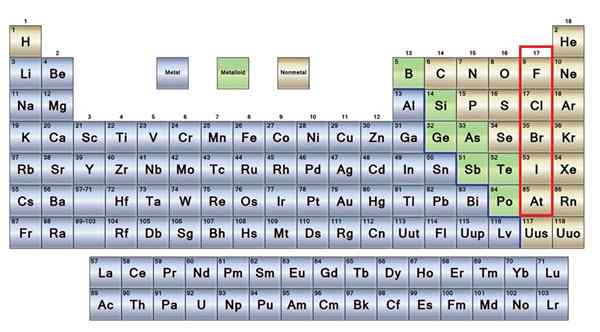 Ei -metalliset elementit ruskeassa
Ei -metalliset elementit ruskeassa Hyvä osa ei -metalleista on läsnä kaikissa elävissä olennoissa yhdisteiden ja makromolekyylien muodossa. Esimerkiksi: Hiili, happi ja vety ovat läsnä kaikissa proteiineissa, lipideissä, hiilihydraateissa ja nukleiinihapoissa.
Fosforia on läsnä kaikissa nukleiinihapoissa ja joissain hiilihydraateissa ja lipideissä. Rikkiä löytyy monista proteiineista. Typpi on osa kaikkia nukleiinihappoja ja proteiineja.
Toisaalta maanalainen, metaanikaasut ja öljy raa'at koostuvat melkein ei -metallisista elementeistä. Itse asiassa hiilivedyt (hiili ja vety) antavat kuvan siitä, kuinka runsas ei -metallit ovat huolimatta niiden pienemmäksi elementtien lukumäärästä jaksollisessa taulukossa.
[TOC]
Historia
Antiikista (3750.C.) Egyptiläiset käyttivät hiiltä mineraalissaan läsnä olevan kuparin, kuten Corvelita ja Malachite, kuparin vähentämiseksi.
Vuonna 1669 Hennin -tuotemerkki onnistui eristämään kerätyn virtsan fosforin. Henry Cavendish (1776) saavutti vedyn tunnistamisen, vaikka useat tutkijat, mukaan lukien Robert Boyle (1670), tuottivat vetyä reagoimalla vahvan hapon metallin kanssa.
Carl Scheele tuotti happea lämmittämällä elohopeaoksidia nitraateilla (1771). Curtois onnistui eristämään jodin yrittäessään valmistaa suolapeterejä merilevästä (1811). Balard ja Gmelin eristivät bomin (1825).
Vuonna 1868 Janssen ja Lockger Independent. Moissan onnistui eristämään fluoridin (1886).
Vuonna 1894 Lord Rayleigh ja Ramsey löysivät Argonin tutkimalla typpiominaisuuksia. Ramsay ja Travers (1898) eristivät nesteen argonin kryptonin, neonin ja ksenonin, kryogeenisen tislauksen avulla.
Fysikaaliset ja kemialliset ominaisuudet
 Rikki on yksi edustavimmista ei -metallisista elementeistä. Lähde: Ben Mills Wikipedian kautta.
Rikki on yksi edustavimmista ei -metallisista elementeistä. Lähde: Ben Mills Wikipedian kautta. Fyysinen
Jotkut ei -metallien fysikaalisista ominaisuuksista ovat:
-Heillä on alhainen sähkönjohtavuus, lukuun ottamatta hiiltä grafiitin muodossa, mikä on hyvä sähköjohdin.
Voi palvella sinua: Heptano (C7H16): rakenne, ominaisuudet ja käytöt-Ne voivat esiintyä kiinteiden aineiden, nesteiden tai kaasujen fysikaalisessa ulkonäössä.
-Heillä on alhainen lämmönjohtavuus, lukuun ottamatta hiiliä timantin muodossa, joka ei käyttäytyy kuin lämpöeriste.
-Heillä on vähän kiiltoa, toisin kuin metallin kirkkaus.
-Ei -metalliset kiintoaineet ovat hauraita, joten ne eivät ole ulottuvia tai muokattavia.
-Heillä on matala sulatus- ja kiehumispisteet.
-Ne voivat esitellä erilaisia kiteisiä rakenteita. Siten fosforilla, hapella ja fluoridilla on kuutiomainen kiteinen rakenne; Vety, hiili ja typpi, kuusikulmainen; ja rikki, kloori, bromi ja jodi, ortorrominen.
Kemia
Ei -metalleille on ominaista, että sillä on korkea ionisaatioenergia ja korkea elektronegatiivisuusarvo. Esimerkiksi fluorilla on suurin elektronegatiivisuus (3,98), joka on ei -metallien reaktiivisin elementti.
Mutta yllättäen, jalokaasujen heliumilla (5.5) ja neonilla (4,84) on suurin elektronegatiivisuus. Ne ovat kuitenkin kemiallisesti inerttejä, että ulkoiset elektroniset kerrokset ovat täynnä.
Ei -metallit muodostavat ionisia yhdisteitä metallien kanssa ja kovalenttiset ei -metallit.
Ei -metalliset elementit muodostavat diatomisia molekyylejä, kytkettynä kovalenttisilla sidoksilla. Samaan aikaan jalokaasujen atomit ovat atomiyksiköiden muodossa.
Ne muodostavat happioksidit, jotka reagoivat veden kanssa.
Ei -metalli- ja elementtiryhmät

Ryhmä 1
Se muodostuu vedystä väritöntä ja wc -kaasua, valintamoottomia. Hapetustila +1. Sillä on vähemmän tiheyttä kuin ilma. Kiinteässä tilassa se esittelee kuusikulmaisen kiteisen rakenteen. Vety on pieni reaktiivinen elementti.
Ryhmä 14
Hiili on ainoa ei -metallinen, joka kuuluu tähän ryhmään. Hiili grafiittimuodossa on kiiltävä kiinteä, kuusikulmainen kiteinen rakenne,. On korkea sähkönjohtavuus. Sen yleisimmät hapetustilat ovat +2 ja +4.
Ryhmä 15
Typpi
Väritön ja wc -kaasu. Se on pieni reaktiivinen elementti ja hiukan tiheämpi kuin ilma. Yleisempi hapetustilat: -3 ja +5. Muodostaa diatomisia molekyylejä, n2.
Ottelu
Kiinteä, sen väri voi olla valkoinen, keltainen tai musta. Pieni reaktiivinen. Ortorrominen kiteinen rakenne. Elektronegatiivisuus 2,1. Yleisempi hapetustilat: -3 ja +5.
Ryhmä 16
Happi
Väritön kaasu tai vaaleansininen, wc. Yleensä ei reaktiivinen. Kuutiomainen rakenne. Se on eriste ja vahva hapettava aine. Elektronegatiivisuus 3.5. Hapetustila -2
Rikki
Kirkkaankeltainen kiinteä, hauras, kohtalaisen reaktiivinen. Ortorrominen kiteinen rakenne. Muodostaa kovalenttisia sidoksia. Elektronegatiivisuus 2.5. Yleisempi hapetustilat: -2, +2, +4 ja +6.
Seleeni
Musta harmaa tai punertavan kiinteä. Harmaa seleeni näyttää kevyen herkän sähkönjohtavuuden. Se on pehmeä ja hauras kiinteä. Elektronegatiivisuus 2.4. Hapetustilat: -2, +2, +4 ja +6.
Voi palvella sinua: kaliumhydroksidi: rakenne, ominaisuudet, käyttötarkoituksetRyhmä 17
Fluori
Se on vaaleankeltainen kaasu, erittäin myrkyllinen. Se on hyvin reaktiivinen elementti. Se esitetään diatomisina molekyyleinä, f2. Kiinteässä tilassa kiteytyy kuutiomuodossa. Elektronegatiivisuus 3.98. Hapetustilat -1.
Kloori
Se on vihreän keltainen kaasu. Esittelee diatomisia molekyylejä, CL2. Se on hyvin reaktiivinen. Kiinteässä tilassa kiteinen rakenne on ortorrominen. Elektronegatiivisuus 3.0. Hapetustilat: - 1, +1, +3, +5, +7.
Bromi
Se on punaisen kasvon neste. Elektronegatiivisuus 2.8. Hapetustilat -1, +1, +3, +5 ja +7.
Jodi
Se on musta kiinteä kiinteä. Ortorrominen kiteinen rakenne. Metallijodidit ovat ionisia. Elektronegatiivisuus 2.5. Hapetustilat: -1, +1, +3, +5, Y +7.
Astato
Se on musta kiinteä. Kuubinen kiteinen rakenne, joka on keskittynyt kasvoihin. Elektronegatiivisuus 2,2. Se on heikko hapettava aine.
Ryhmä 18
Helium
On korkea lämmönjohtavuus. Elektronegatiivisuus 5.5. Se on kemiallisesti inertti eikä syttyvä. Alhainen tiheys ja korkea sujuvuus.
Neon
Korkea jäähdytyskyky nestemäisessä tilassa. Elektronegatiivisuus 4.84. Se on jalokaasujen vähiten reaktiivinen.
Argoni
Se on tiheämpi kuin ilma. Kemiallisesti inertti. Elektronegatiivisuus 3.2.
Krypton
Elektronegatiivisuus 2.94. Voi reagoida fluoridin kanssa kryptonin difluoridin muodostamiseksi (KRF2-A.
Ksenoni
Ylittää veren aivoesteen. Reagoi sähkövirtaan tuottavaan valoon. Elektronegatiivisuus 2,2. Kompleksi muoto fluorin, kullan ja hapen kanssa.
Radon
Se on radioaktiivinen elementti. Elektronegatiivisuus 2.06. Muodostavat yhdisteitä fluoridilla (RNF2) ja happea (RNO3-A.
Sovellukset
Vety

Sitä käytetään rakettien työntövoimassa ja vetykäyttöisissä automoottoreissa, jotka käyttävät vetyä. Sitä käytetään ammoniakkisynteesissä (NH3) ja rasvojen hydrauksessa.
Hiili
Grafiittia käytetään lyijykynien ja korkean resistenssikuitujen valmistuksessa, joita käytetään urheiluartikkeleiden laatimisessa. Timanttia käytetään suuren arvon koroksena ja porausporaissa hioma -aineena. Hiilidioksidia käytetään virvoitusjuomien kehittämisessä.
Typpi
Sitä käytetään ammoniakin, typpihapon ja urean tuotannossa. Typpi on olennainen elementti kasveille, ja sitä käytetään lannoitteiden valmistuksessa.
Ottelu
Valkoista fosforia käytetään raticidina, hyönteismyrkkynä ja pyroteknisellä teollisuudessa. Punainen fosforia käytetään otteluiden valmistuksessa. Sen yhdisteitä käytetään myös lannoitteiden kehittämisessä.
Happi
Happea käytetään teräksen, muovien ja tekstiilien kehittämisessä. Sitä käytetään myös raketti-, happiterapiassa ja hengitysapua lentokoneissa, sukellusveneissä ja avaruuslennoissa.
Voi palvella sinua: Erbio: rakenne, ominaisuudet, hankkiminen, käyttöRikki
Sitä käytetään raaka -aineena rikkihapon, ruutin ja kumien vulkanoinnin tuottamiseen. Sulfiittejä käytetään valkaisuaineiden ja sienitautien torjunta -aineisiin.
Seleeni
Sitä käytetään antamaan scarlet -punainen väri lasille. Sitä käytetään myös vihertävän vivahteen neutraloimiseen, joka on tuotettu lasitaudalla rautayhdisteillä. Sitä käytetään valosähköisissä soluissa, joissa on levitys ovissa ja hisseissä.
Fluori

Se lisätään hammasvoiteisiin kariesin estämiseksi. Vetyfluoridia käytetään raaka -aineena teflonille. Monooatomia fluoria käytetään puolijohteiden valmistuksessa.
Kloori
Sitä käytetään kaivannaisan metallurgiassa ja hiilivetykloorauksessa erilaisten tuotteiden, kuten PVC: n, valmistukseen. Klooria käytetään puu- ja tekstiilimassan valkaisussa. Sitä käytetään myös veden desinfiointiaineena.
Bromi
Sitä käytetään hopeabromidin valmistuksessa kevyille herkille linsseille ja valokuvakaloissa sitä käytetään myös sedatiivisen natriumbromidin ja dibrometaanin, bensiinin anti -domain -komponentin kehittämisessä.
Jodi
Kaliumjodidia (KI) lisätään kilpirauhasen hankkimiseksi. Jodi -tinktuuria käytetään antiseptisenä ja sukusoluissa. Jodi on osa kilpirauhashormoneja.
Helium
Sitä käytetään kuumailmapallojen täyttämisessä ja sekoitettuna hapen kanssa syvän veden hengityksestä. Sitä käytetään hitsauksiin inertissä ilmakehässä ja auttaa ylläpitämään erittäin alhaisia tutkimuslämpötiloja.
Neon
Lasiputkissa, jotka valaisevat sähkön toimintaan (neon punaiset valot).
Argoni
Sitä käytetään hitsausilmapiirin luomiseen ja hehkulamppujen täyttämiseen.
Ksenoni
Ksenonin ja Cryptonin seosta käytetään suuren voimakkuuden välähdyksen tuotannossa lyhyen aikavälin valokuvanäyttelyssä.
Radon
Sitä käytetään syöpäkasvaimien hoidossa sädehoidolla.
Viitteet
- Whitten, Davis, Peck & Stanley. (2008). Kemia. (8. ed.-A. Cengage -oppiminen.
- Shiver & Atkins. (2008). Epäorgaaninen kemia. (Neljäs painos). MC Graw Hill.
- Mathews, c. K -k -., Van Holde, K. JA. Ja ahern, k. G. (2002). Biokemia. Kolmas painos. Muokata. Pearson-Addison Wesley
- Helmestine, Anne Marie, PH.D -d. (6. lokakuuta 2019). Mitkä ovat ei -metallien ominaisuudet? Toipunut: Admingco.com
- Wikipedia. (2019). Ei -metalli-. Haettu: vuonna.Wikipedia.org
- Enyclopaedia Britannica -toimittajat. (5. huhtikuuta 2016). Ei -metalli-. Encyclopædia britannica. Toipunut: Britannica.com
- Jose M. Gavira Vallejo. (27. tammikuuta 2016). Mitkä ovat pnicogenit? Ja icosogenos, kristallogeenit, kalsogeenit .. ? Haettu: Triplenlace.com
- « Fluori -historia, ominaisuudet, rakenne, hankkiminen, riskit, käyttää
- Mikä on, tyypit ja ominaisuudet »

