Kaliumfluori (KF)
- 1571
- 120
- Edgar VonRueden
 Kaliumfluoridirakenne. Lähde: Benjah-BMM27, Wikimedia Commons
Kaliumfluoridirakenne. Lähde: Benjah-BMM27, Wikimedia Commons Mikä on kaliumfluori?Hän Kaliumfluori Se on epäorgaaninen halogenidi, joka koostuu suolasta, joka muodostuu metallin ja halogeenin väliin. Sen kemiallinen kaava on KF, mikä tarkoittaa, että jokaiselle kationille K+ On f- vastoin. Vuorovaikutukset ovat sähköstaattisia, ja seurauksena ei ole K-F-kovalenttisia linkkejä.
Tälle suolalle on ominaista sen äärimmäinen liukoisuus vedessä, joten se muodostaa hydraatit, imee kosteuden ja on herkullinen. Siksi siitä on erittäin helppo valmistaa vesiliuoksia, jotka toimivat fluoridianionien lähteenä kaikille niille synteesille, jossa sitä halutaan sisällyttää se johonkin rakenteeseen.
KI tuotetaan reagoimalla kaliumkarbonaattia fluoriarhorihapon kanssa, tuottaen kaliumbifluoridia (KHF2), joka lämpöhajoamisen vuoksi lopulta aiheuttaa kaliumfluoridin.
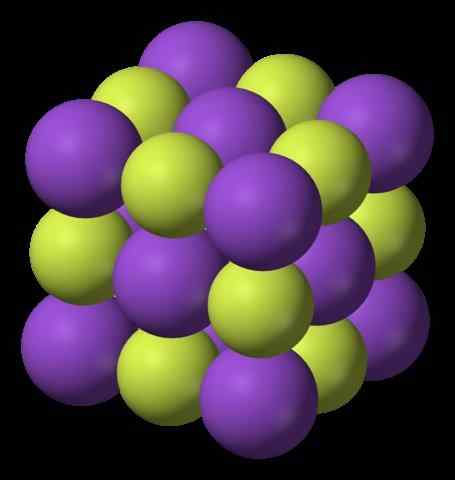
Kaliumfluoridirakenne
Yläkuva näyttää kaliumfluoridin rakenteen. Violetti pallot edustavat kationeja k+, Kun taas kellertävät pallot edustavat anioneja f-.
Huomaa, että järjestely on kuutio ja vastaa GEMA -suolarakennetta, hyvin samanlainen kuin natriumkloridi. Kaikkia palloja ympäröivät kuusi naapuria, jotka muodostavat oktaedron KF: n6 tai fk6, eli kukin k+ Sitä ympäröi kuusi f-, Ja sama koskee päinvastoin.
Aikaisemmin mainittiin, että KF on hygroskooppinen ja siksi imee ympäristön kosteuden. Siten esitetty järjestely vastaisi vedettömää muotoa (ilman vettä) eikä sen hydraatteja, jotka absorboivat niin paljon vettä, joka jopa liukenee ja "sulaa" (herkut).
Voi palvella sinua: Neon: Historia, ominaisuudet, rakenne, riskit, käyttötarkoituksetHydraatit
Hydraattien kiteiset rakenteet muuttuvat vähemmän yksinkertaisiksi. Koska nyt vesimolekyylit puuttuvat suoraan järjestelyihin ja ovat vuorovaikutuksessa K -ionien kanssa+ ja f-. Yksi vakaimmista hydraateista on KF · 2H2O y kf · 4h2JOMPIKUMPI.
Molemmissa hydraateissa äskettäin mainittu oktaedra on muodonmuutos vesimolekyylien takia. Tämä johtuu pääasiassa vety sillasta F: n välillä- ja h₂o (f--Hoh). Kristallografiset tutkimukset ovat päättäneet, että tästä huolimatta nämä kaksi ionia ylläpitävät edelleen saman määrän naapureita.
Seurauksena on, että vedettömän kaliumfluorin alkuperäinen kuutiorakenne.
Anhydrot jakavat herkut.
Kaliumfluoridiominaisuudet
- Molekyylipaino: 58 097 g/mol.
- Fyysinen ulkonäkö (väri): Valkoiset kuutiokidet tai herkut kiteinen pöly.
- Maku: akuutti suolaliuosmaku.
- Kiehumispiste: 2.741 ° F 760 mmHg: ssa (1502 ° C). Nestemäisessä tilassa siitä tulee sähkönjohdin, vaikka anionit f toukokuu- Älä tee yhteistyötä samassa asteessa kuin k+.
- Sulamispiste: 1.576 ° F; 858 ° C; 1131 K (KF Anhidro). Tämä osoittaa sen vahvat ioniset linkit.
- Liukoisuus: Liukoinen HF: ssä, mutta liukenematon alkoholiin. Tämä osoittaa, että vety sillat fluoridin ja alkoholien välillä, F--Hor, he eivät suosittele solvaatioprosessia sen kiteisen verkon liukenemista vastaan.
- Vesiliukoisuus: Vedetön 92 g/100 ml (18 ° C); 102 g/100 ml (25 ° C); Dihydraeri 349,3 g/100 ml (18 ° C). Toisin sanoen, koska KF on hydratoitunut, se liukenee veteen.
- Tiheys: 2,48 g/cm3.
- Höyrynpaine: 100 kPa (750 mm Hg) 1: ssä.499 ° C.
- Hajoaminen: Kun hänet kuumennetaan hajoamiseen, hän emittoi toksisen savun kaliumoksidista ja vetyfluoridista.
- Syövyttävä toiminta: Vesiliuos syövyttää lasia ja posliinia.
- Leimahduspiste: Se ei ole syttyvä aine
- Kokeellinen taitekerroin (ηD): 1.363.
- Vakaus: vakaa, jos se on suojattu kosteukselta, koska muuten kiinteä aine on liuennut. Yhteensopimaton vahvojen happojen ja emäksen kanssa.
Kaliumfluori käyttää
- Säätää pH: ta: Vesipitoiset kaliumfluoridiliuokset käytetään teollisissa sovelluksissa ja prosesseissa. Esimerkiksi KF -ratkaisut mahdollistavat pH: n säätämisen valmistuksissa, jotka suoritetaan tekstiiliprosessoissa ja pesulapalveluissa (ne arvioivat arvoa 7).
- Fluorilähde: Kaliumfluoridi on vetyfluoridin jälkeen fluoridin saamisen päälähde. Tätä elementtiä käytetään ydinlaitoksissa ja epäorgaanisten ja orgaanisten yhdisteiden tuotannossa, joissakin käyttötarkoituksissa, kuten niiden sisällyttäminen denttifrikeihin.
- Fluorihastikielen synteesi: Kaliumfluoridia voidaan käyttää fluoriruuan tai fluorikarbidin synteesissä klorokarbonista käyttämällä finkeisteiinireaktiota. Tässä reaktiossa etyleeniglykolia ja dimetyylisulfoksidia käytetään liuottimina.
- Fluora: Kuten fluorilähde, jossa se on vedessä liuenneena, niiden liuoksistaan he voivat syntetisoida kompleksisia fluorideja, ts. Ne sisällytetään F: n kanssa- rakenteisiin. Esimerkki on seuraavassa kemiallisessa yhtälössä:
Mnbr2(AC) + 3kf (AC) => kmnf3(S) + 2KBR (AC)
- Sitten saostuu KMNF: n sekoitettu fluori3. Siten F voitaisiin lisätä- olla osa monimutkaista metallisuolaa. Mangaanin lisäksi muiden metallien fluoridit voivat kiirehtiä: KCOF3, Kfef3, Veif3, Kcf3 ja kznf3.
- Samoin fluori voidaan sisällyttää kovalenttisesti aromaattiseen renkaaseen, syntetisoi organisaatiota.
- Useat: KF: ää käytetään välituotteena tai raa'ana materiaalina yhdisteiden synteesiä varten, joita käytetään pääasiassa maatalouden tai torjunta -aineiden tuotteissa.
- Lisäksi sitä käytetään hitsauksen perustaja -aineena.
Viitteet
- Kaliumfluori. Palautettu kemikaalikirjasta.com.
- Kaliumfluori. PubChemistä toipunut.NCBI.Nlm.NIH.Hallitus.

