Natriumfosfaattirakenne, ominaisuudet, synteesi, käyttää

- 2556
- 803
- Gabriel Fahey
Hän Natriumfosfaatti Se on epäorgaaninen suola, jonka kemiallinen kaava on Na3Poikki4. Se vastaanottaa myös TRISODIS -fosfaattien nimet (TSP sen lyhenteelle englanniksi: Trisodiumfosfaatti) tai tribasinen natriumfosfaatti, koska sillä ei ole täysin kykyä luovuttaa vety -ioneja H+.
Kun viitataan siihen monella tavalla, natriumfosfaatit, puhuu koko suolakomentin, hydratoituneesta tai ei, johtuen Na Na: n välisestä sähköstaattisesta vuorovaikutuksesta+ ja PO43-. Jotkut näistä suoloista koostuvat jopa natriumpyrofosfaateista tai epäorgaanisista polymeereistä, joilla on PO43- monomeerinä.
 Kellalasi natriumfosfaattikiteillä. Lähde: Ondřej Mangl [julkinen alue]
Kellalasi natriumfosfaattikiteillä. Lähde: Ondřej Mangl [julkinen alue] Siksi, ellei spesifikaatiota ole tehty, se viittaa aina NA: hon3Poikki4, Ja ei Nahille2PO4, NA2HPO4, Naa4P2JOMPIKUMPI7 Ei mitään muuta suolaa.
Yläkuva näyttää natriumfosfaatin ulkonäön, joka näyttää valkoisen kiteenä kuin tavallisen suolan tai pöydän, tai ostettu valkoisena amorfisen näköisenä jauheena. Sitten eräs3Poikki4 pystyy muodostamaan useita hydraatteja, koska se on NA3Poikki4· 12H2Tai sitä, jota markkinoidaan eniten.
Se löytää käyttöä pääasiassa elintarviketeollisuudessa, pesuaineissa, urheilulisäaineissa ja toimii hyperosmoottisena laksatiivina.
[TOC]
Kemiallinen rakenne
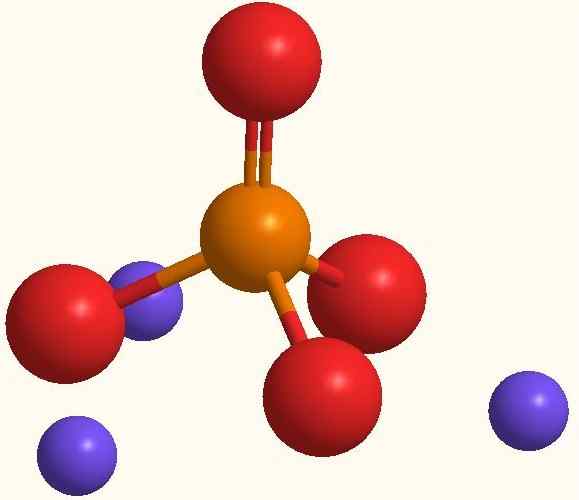 Natriumfosfaatin pää -ionit. Lähde: Smolamj Wikipedian kautta.
Natriumfosfaatin pää -ionit. Lähde: Smolamj Wikipedian kautta. Sama Na -kaava3Poikki4 osoittaa, että jokaiselle anionille PO: lle43- Na -katioita on kolme+. Nämä ionit voidaan havaita ylemmässä kuvassa. Huomaa, että PO43- Siinä on tetraedrinen geometria, ja sen happiatomeilla on resonanssi negatiivinen kuorma, joka houkuttelee NA: ta+ ympäristö.
Myös NA -kaava3Poikki4 Hän huomauttaa, että se on vedetön suola, joten heidän kiteisiinsa ei ole vesimolekyylejä. NA: n väliset sähköstaattiset nähtävyydet+ ja PO43- He lopulta määrittelevät trigonaalisen valkoisen kristallin. Sen ioninen linkki on sellainen, että na3Poikki4 Sen fuusiopiste on 1583 ºC, huomattavasti korkeampi kuin useiden suolojen.
Voi palvella sinua: Cannizzaro -reaktio: Ominaisuudet, mekanismit, esimerkitMolemmat NA+ Kuin Po43- Ne ovat ioneja, jotka voidaan hydratoitua korkeassa asteessa, vaikuttamatta negatiivisesti kiteiden stabiilisuuteen.
Tästä syystä hydraatit voivat myös kiteyttää; Sen sulatuspisteet ovat kuitenkin alhaisemmat kuin vedettömän suolan, koska veden väliset vety sillat erottavat ionit ja heikentävät niiden vuorovaikutusta. NA: ssa3Poikki4· 12H2Tai esimerkiksi sen sulamispiste on 73,4 ºC, paljon vähemmän kuin Na3Poikki4.
Ominaisuudet
Fyysinen ulkonäkö
Se voi tapahtua määriteltyinä valkoisina kiteinä tai samanvärisinä pölyinä tai rakeina. Kaikki alla ilmaistut fyysiset suuruudet viittaavat vain naiiviseen suolaan3Poikki4.
Sulamispiste
1583 ºC
Kiehumispiste
100 ºC
Vesiliukoisuus
14,5 g/100 ml 25 ° C: ssa, joten sitä pidetään melko liukoisena veden fosfaattina. Se on kuitenkin liukenematon orgaanisiin liuottimiin, kuten etanoliin ja hiilidisulfidiin.
Tiheys
2 536 g/cm3 nopeudella 17,5 ºC.
Vakaus
Se on hygroskooppinen kiinteä aine. Siksi se on säilytettävä siten, että sitä ei voida altistaa kosteudelle.
PHE
Se on voimakkaasti emäksinen suola. Esimerkiksi sen vesiliuoksella 0,1% on jo pH 11,5. Tämä ominaisuus on käytetty additiivina pesuaineissa.
Synteesi
Kuinka natriumfosfaattia tuotetaan tai syntetisoidaan? Tätä varten se perustuu fosforihappoon, H3Poikki4, tai suolafosfaattisuolatriumista, NAH: sta2Poikki4.
Suurimmassa osassa synteesistä H on suositeltava3Poikki4. Siten H reagoi3Poikki4 Emäksellä, joka neutraloi sen kolme OH -ryhmää ottaen huomioon, että tämä happo voidaan kirjoittaa myös PO (OH)3.
Voi palvella sinua: Aihetasapaino: Mikä on, yleinen yhtälö, tyypitPohja -pohja on natriumhydroksidi, NaOH (Saksassa), mutta se on myös elinkelpoinen (ja halvempi) käyttää natriumkarbonaattia tai Sosan tuhkaa, na2Yhteistyö3 (Yhdysvalloissa). Molempien neutralointireaktioiden yhtälöt ovat:
Naa2Yhteistyö3 + H3Poikki4 → NA2HPO4 + Yhteistyö2 + H2JOMPIKUMPI
Naa2HPO4 + NaOH → NA3Poikki4 + H2JOMPIKUMPI
Huomaa, että käytettäessä NA: ta käytetään2Yhteistyö3 NA: ta ei saatu3Poikki4 mutta na2HPO4, joka tarvitsee myöhempää neutralointia. Vesipitoinen reaktio tarkoittaa, kiteyttää NA: n3Poikki4· 12H2Tai, joten se on laskettava sen vesipitoisuuden poistamiseksi ja vedettömän suolan aiheuttamiseksi.
Sitten eräs3Poikki4· 12H2O Sille on ominaista kiteidensä "yhdistäminen" vaikeassa kompaktissa massassa. Mitä pienempi niiden kiteiden koko on, sitä nopeammin sen kalsinointi on.
Sovellukset
Ruoka
 Natriumfosfaattia käytetään poreilevana aineena kaneliroolien tai kakkujen laajentamiseksi. Lähde: Pixabay.
Natriumfosfaattia käytetään poreilevana aineena kaneliroolien tai kakkujen laajentamiseksi. Lähde: Pixabay. Natriumfosfaatissa käytetään VA: n sekoittamista väistämätöntä3Poikki4 tai na NA3Poikki4· 12H2Tai koska jälkimmäinen on hydraatti, jota markkinoidaan eniten. Esimerkiksi jompikumpi kahdesta tarjoaa vaarattomia (teoriassa) ioneja ruokaan, johon ne lisätään, rikastuttaen niitä fosfaateista ja lisäävät samalla suolapitoisuuttaan.
Lihan salarissa NA3Poikki4· 12H2Tai on mukana pitämässä niitä tuoreina pidempään varastossaan. Sitä lisätään myös emulgoivana aineena siten, että öljy-vesiseosta ei "leikata", vaan se pysyy yhtenäisenä; Ja pH -säätelijänä, koska se auttaa vähentämään ruoan happamuutta (mukaan lukien viljat).
Voi palvella sinua: kalsiumsilikaatti: Ominaisuudet, rakenne, hanki, käyttääLisäksi sitä käytetään joidenkin tomaattikastikkeiden sakeuttamiseen ja kakun tai leivän leivontaan (ylivoimainen kuva). Jälkimmäinen johtuu siitä, että na3Poikki4· 12H2Tai pyrkii vapauttamaan vesihöyryä, mikä lisää jauhesmassan huokosten kokoa ja sen tilavuutta.
Pesuaineet
Natriumfosfaatti on riittävän emäksinen saponifioimaan joitain rasvoja tai öljyjä, joihin sinulla on kosketus. Sen alkalisuutta käytetään sitten pesuaineiden vaikutuksen parantamiseen, kunhan pinta kurjuuteen ei ole metalli, koska ne voivat huonontaa sitä.
Fosfaateilla rikastettujen pesuaineiden tuotanto on kuitenkin vähentynyt, koska ne tuottavat järvien ja jokien rehellisyyden ja sen kanssa niiden pintojen kattamisen leviämisen.
Sitä on käytetty myös desinfiointiaineen kehittämiseen: na3Poikki4· 1/4NAOCL · 11H2Tai, joka valmistetaan käyttämällä natriumhypokloriittia, Naocl, NaOH: n tai Na: n sijasta2Yhteistyö3 H -neutraloida3Poikki4.
Lääketieteellinen
Sitten eräs3Poikki4 Se indusoi defekaatiota toimimalla hyperosmoottisena laksatiivina, joka on tarpeen paksusuolen puhdistamiseksi ennen kuin potilas läpäisee kolonoskopian. Toisaalta sitä on käytetty (lisätty) energialisäaineita.
Viitteet
- Shiver & Atkins. (2008). Epäorgaaninen kemia. (Neljäs painos). MC Graw Hill.
- Kansallinen bioteknologiatietojen keskus. (2019). Trisodiumfosfaatti. Pubchem -tietokanta. CID = 24243. Toipunut: Pubchem.NCBI.Nlm.NIH.Hallitus
- Wikipedia. (2019). Trisodiumfosfaatti. Haettu: vuonna.Wikipedia.org
- Curran m.P. & Plosker g.Lens. (2004). Suun kautta annettava natriumfosfaattiliuos: Katsaus sen käyttötarkastukseen kolorektaaliseen puhdistusaineen. Doi: 10.2165/00003495-200464150-00009
- Corey Whelan. (22. joulukuuta 2017). Natriumfosfaatti. Toipunut: Healthline.com
- Jacobs, Joel B. Taborosi, Steve. (2019). Trisodiumfosfaatin tuotantoprosessi. Haettu: FreePaTentssonline.com
- Maryann Marks. (2018). Miksi trisodiumfosfaatti (TSP) lisätään ruokaan? Toipunut: Theingredientguru.com

