Puoli -kehittynyt kaava Mikä on ja esimerkkejä (metaani, propaani, butaani ...)
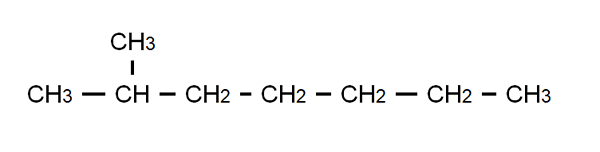
- 2375
- 514
- Louis Moen
Se Puoliksi kehitetty kaava, Tunnetaan myös nimellä puolirakenteinen kaava, se on yksi monista mahdollisista esityksistä, jotka voidaan antaa yhdisteen molekyylille. Se on hyvin toistuva orgaanisessa kemiassa, etenkin akateemisissa teksteissä, koska sen kanssa esitetään oikea molekyylin ja sen kovalenttiset sidokset.
Toisin kuin kehitetty kaava, josta tulee sama kuin rakenteellinen kaava, se ei näytä C-H-sidoksia, jättäen ne pois esityksen yksinkertaistamiseksi. Tästä kaavasta kuka tahansa lukija pystyy ymmärtämään, mikä on molekyylin luuranko; Mutta ei sen geometriaa tai mitään stereokemiallisia näkökohtia.
 2-metyylipeptanon puoliksi kehitetty kaava. Lähde: Gabriel Bolívar.
2-metyylipeptanon puoliksi kehitetty kaava. Lähde: Gabriel Bolívar. Tämän selventämiseksi meillä on 2-metyylipeptanon puoliksi kehitetty kaava: haarautunut alkaani, jonka molekyyl kaava on c on8H18, ja se tottelee yleistä kaavaa CnH2N+2. Huomaa, että molekyylikaava ei sano mitään rakenteesta, kun taas puoliksi kehitetty se mahdollistaa visualisoida, mikä tämä rakenne on.
Samoin huomaa, että C-H-sidokset jätetään pois, korostaen vain C-C-sidoksia, jotka muodostavat hiilihapotetun ketjun tai luurankon. Nähdään, että yksinkertaisissa molekyyleissä kehitetty kaava osuu tiivistetyn kaavan kanssa; ja jopa molekyylillä.
[TOC]
Esimerkit
Metaani
Metaanin molekyylinen kaava on CHO4, No, siinä on neljä C-H-linkkiä ja se on tetraedrinen geometria. Nämä tiedot saadaan rakenteellinen kaava kiiloilla tason ulkopuolella tai alapuolella. Metaanille tiivistetystä kaavasta tulee myös CHO4, Kuten empiirinen ja puoliksi kehitetty. Tämä on ainoa yhdistelmä, josta sanottu singulaarisuus täyttyy.
Syy, miksi metaanin puoliksi kehitetty kaava on CHO4, Se johtuu siitä, että heidän C-H-linkkejä ei ole kirjoitettu; Tätä varten se vastaa rakenteellista kaavaa.
Voi palvella sinua: SolvaatioPropaani
Propaanin puoliksi kehitetty kaava on CHO3-CH2-CH3, on vain kaksi C-C-linkkiä. Sen molekyyli on lineaarinen, ja jos se osoittaa, sen tiivistynyt kaava on täsmälleen sama: CHO3CH2CH3, Ainoan eron kanssa C-C-linkit jätetään pois. Propaanille on täyttynyt, että sekä osittain kehitetty että tiivistynyt kaava osuvat samanaikaisesti.
Itse asiassa tämä toteutetaan kaikille lineaaristen ketjujen alkaanille, koska se jatkuu seuraavissa osissa.
Butaani
Puoli -kehittynyt butaanikaava on CHO3-CH2-CH2-CH3. Huomaa, että se voidaan kirjoittaa samalla rivillä. Tämä kaava vastaa tiukasti n-butaani, mikä osoittaa, että se on lineaarinen ja harhauttamaton isomeeri. Haaroittuneella isomeerillä, 2-metyylipropanilla, on seuraava puoliksi kehittynyt kaava:
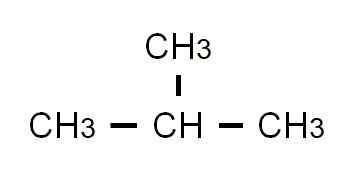 2-metyylipropaanin puoliksi kehitetty kaava. Lähde: Gabriel Bolívar.
2-metyylipropaanin puoliksi kehitetty kaava. Lähde: Gabriel Bolívar. Tällä kertaa sitä ei voida enää kirjoittaa tai edustaa samalla linjalla. Näillä kahdella isomeerillä on sama molekyyl kaava: C4H10, joka ei auta syrjintää toisistaan.
Pentaneo
Meillä on jälleen toinen alkaani: Pentan, jonka molekyyl kaava on c5H12. Puoliksi kehitetty kaava n-Pentaneo on ch3-CH2-CH2-CH2-CH3, Helppo edustaa ja tulkita ilman tarvetta sijoittaa C-H-linkkejä. Ryhmät ch3 Ne ovat SO -nimeämä metyyli tai metyyli ja Choons2 Ne ovat metyleeniä.
Pentanissa on muita haarautuneita rakenteellisia isomeerejä, joita havaitaan alemmassa kuvassa, jota edustavat vastaavat puoliksi kehittyneet kaavat:
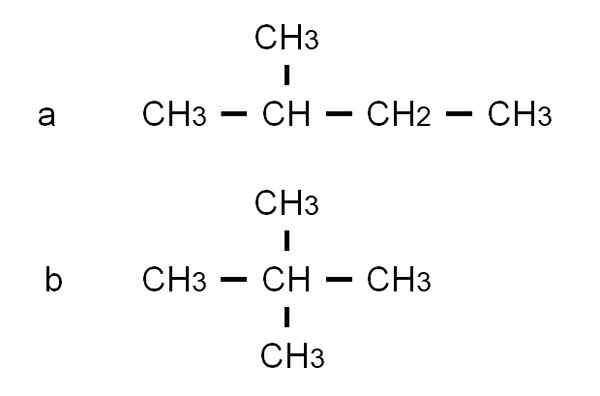 Pentanin kahden haarautuneen isomeerin puoliksi kehittyneet kaavat. Lähde: Gabriel Bolívar.
Pentanin kahden haarautuneen isomeerin puoliksi kehittyneet kaavat. Lähde: Gabriel Bolívar. Isomeeri -lla Se on 2-metyylibutaani, jota kutsutaan myös isopentanoksi. Samaan aikaan isomeeri b - Se on 2,2-dimetyylipropaania, joka tunnetaan myös nimellä Neopentano. Sen osittain kehitetyt kaavat tekevät selväksi kahden isomeerin välisen eron; Mutta hän ei sano paljon siitä, kuinka tällaiset molekyylit näyttäisivät avaruudessa. Tätä varten rakenteelliset kaavat ja mallit ottaisivat.
Voi palvella sinua: Sulfonihappo: rakenne, nimikkeistö, ominaisuudet, käytötEtanoli
Puoli -kehittyneitä kaavoja ei käytetä vain alkaaneissa, alkeenissa tai alkyneissä, vaan minkä tahansa tyyppisissä orgaanisissa yhdisteissä. Siten etanolilla, alkoholilla, on puoliksi kehitetty kaava: ch3-CH2-vai niin. Huomaa, että C-O-linkki on nyt edustettuna, mutta ei O-H-linkkiä. Kaikki vety sidokset halveksitaan.
Lineaarisia alkoholeja on helppo edustaa aivan kuten Alkanes. Yhteenvetona: Kaikki lineaaristen molekyylien puoliksi kehittyneet kaavat on helppo kirjoittaa.
Dimetyyli
Eetteriä voidaan edustaa myös puoliksi kehitetyillä kaavoilla. Dimetyylivaarassa, jonka molekyyl kaava on c2H6Tai puoliksi kehitetty on: CHO3-O-CH-CH-3. Huomaa, että dimetyyli ja etanoli ovat rakenteellisia isomeerejä, koska niillä on sama molekyyl kaava (kerro C, H ja O) atomeista.
Sykloheksa
Haarautuneiden yhdisteiden puoliksi kehitetyt kaavat ovat työläisempiä edustamaan kuin lineaarisia; Mutta syklisiä yhdisteitä, kuten sykloheksania. Sen molekyyl kaava vastaa sitä kuten hekseniin ja sen rakenteellisiin isomeereihin: c6H12, Koska kuusikulmainen rengas on tyydyttymättömyys.
Sykloheksanin edustamiseksi vedetään kuusikulmainen rengas, jonka kärjessä metyleeniryhmät sijaitsevat, ch2, Aivan kuten alla:
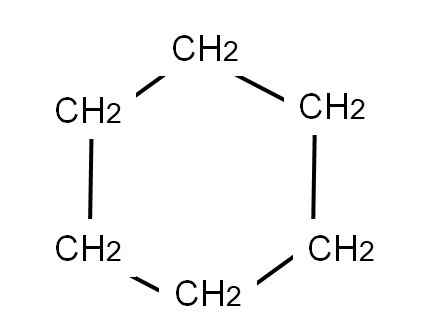 Syklohexan puoliksi kehitetty kaava. Lähde: Gabriel Bolívar.
Syklohexan puoliksi kehitetty kaava. Lähde: Gabriel Bolívar. Sykloheksaanin kehittynyt kaava näyttäisi C-H-linkit, ikään kuin renkaassa olisi television ”antenneja”.
Fosforihappo
Fosforihapon molekyylinen kaava on H3Poikki3. Monille epäorgaanisille yhdisteille molekyylin kaava riittää, jotta käsitys on rakenteesta. Mutta on olemassa useita poikkeuksia, ja tämä on yksi niistä. Sen kanssa, että h3Poikki3 Se on diproottinen happo, puoliksi kehitetty kaava on: HPO (OH)2.
Voi palvella sinua: Neopentil: rakenne, ominaisuudet, nimikkeistö, koulutusToisin sanoen yksi hydrogeista on suoraan yhteydessä fosforiatomiin. Kuitenkin kaava H3Poikki3 Se myöntää myös molekyylin, jolla on puoliksi kehitetty kaava: PO (OH)3. Molemmat ovat itse asiassa mitä tautomeerit tietävät.
Epäorgaanisen kemian puoliksi kehittyneet kaavat ovat hyvin samankaltaisia kuin orgaanisessa kemiassa tiivistetyt. Epäorgaanisissa yhdisteissä, koska heillä ei ole C-H-sidoksia ja yksinkertaisempia, niiden molekyyliset kaavat yleensä riittävät kuvaamaan niitä (kun ne ovat kovalenttisia yhdisteitä).
Yleinen kommentti
Puoli -kehitetyt kaavat ovat hyvin yleisiä, kun opiskelija oppii nimikkeistön säännöt. Mutta kun kemian muistiinpanot ovat yleensä assimiloituneet, se on täynnä luurankoisia rakenteellisia kaavoja; Eli C-H-linkit jätetään pois, vaan myös säästää aikaa, kun sivuutetaan C.
Loput, orgaanisessa kemiassa tiivistetyt kaavat ovat toistuvampia kuin puoliksi kehitetyt, koska entiset eivät tarvitse edes kirjoittaa linkkejä kuten toisessa. Ja epäorgaanisen kemian suhteen näitä puolialoa kehitettyjä kaavoja käytetään vähemmän.
Viitteet
- Whitten, Davis, Peck & Stanley. (2008). Kemia. (8. ed.-A. Cengage -oppiminen.
- Wikipedia. (2020). Puoliksi kehitetty kaava. Palautettu: on.Wikipedia.org
- Siyavula. (S.F.-A. Orgaaniset molekyylirakenteet. Toipunut: Siyavula.com
- Jean Kim & Kristina Bonnett. (5. kesäkuuta 2019). Orgaanisten rakenteiden piirtäminen. Kemian librettexts. Palautettu: Chem.Librettexts.org
- Opettajat. Marl ja Jla. (S.F.-A. Johdanto hiiliyhdisteisiin. [PDF]. Haettu: IPN.MX
- « Kestävä kulutus siihen, mikä on käyttö, merkitys, toimet, esimerkit
- Palautuvat reaktioominaisuudet ja esimerkit »

