Fosforihistoria, ominaisuudet, rakenne, hankkiminen, käyttö

- 1956
- 553
- Alonzo Kirlin
Hän ottelu Se on ei -metallinen elementti, jota edustaa kemiallinen symboli P ja jolla on atominumero 15. Se esittelee kolme pääajooppimuotoa: valkoinen, punainen ja musta fosfori. Valkoinen fosfori on fosforesoivaa, polttaa spontaanisti ilmaan altistuessaan ja on myös erittäin myrkyllinen.
Valkoisesta fosforista 250 ° C lämpötilassa muuttuu punaiseksi fosforiksi; polymeerinen muoto, liukenematon ja joka ei palaa ilmassa. Korkeissa lämpötiloissa ja paineissa, samoin kuin katalyyttien läsnä ollessa tai ei, saadaan musta fosfori, joka muistuttaa grafiittia ja on hyvä sähköjohdin.
 Valkoinen fosfori, joka on varastoitu pulloon vedellä. Lähde: W. Oelen [CC BY-SA 3.0 (https: // creativecommons.Org/lisenssit/by-SA/3.0)]
Valkoinen fosfori, joka on varastoitu pulloon vedellä. Lähde: W. Oelen [CC BY-SA 3.0 (https: // creativecommons.Org/lisenssit/by-SA/3.0)] Fosfori eristettiin ensimmäistä kertaa h. Brändi, vuonna 1669. Tätä varten virtsa käytettiin tämän elementin lähteenä. Vuonna 1770, W. Scheele huomasi, että hän pystyi myös eristämään luufosforin.
Myöhemmin, johtuen sähköuunin luomisesta j: llä. Burgess Readman (1800), fosfaattikivet tulivat fluorapatiittimalmin fosforin tuotannon tärkein lähde,.
Fosfori on maankuoren kaksitoista runsaampaa elementtiä ja edustaa 0,1% siitä painon mukaan. Lisäksi se on kuudes elementti runsaasti ihmiskehossa; pääasiassa luihin keskittyneen hydroksylapatiitin muodossa.
Siksi se on olennainen osa eläviä olentoja, ja siitä tulee yksi kolmesta kasvien pääravinteesta. Fosfori on osa nukleiinihappojen kemiallista rakennetta; energian varastointiyhdisteitä (ATP), koentsyymejä; ja yleensä aineenvaihduntayhdisteistä.
[TOC]
Historia
- Löytö
Virtsassa
 Joseph Wright Derby -maalauksesta, jossa fosforin löytö kuvaa. Lähde: Derbyn Joseph Wright [julkinen alue]
Joseph Wright Derby -maalauksesta, jossa fosforin löytö kuvaa. Lähde: Derbyn Joseph Wright [julkinen alue] Henning -tuotemerkki eristettiin fosforia vuonna 1669, koska se oli ensimmäinen ihminen, joka eristi elementin. Brand oli saksalainen alkemisti Hampurista ja onnistui saamaan fosforiyhdisteen virtsasta. Tätä varten hän kokosi 50 kauhan virtsan ja antoi hänelle mahdollisuuden hajottaa.
Sitten brändi haihdutti virtsaa ja sai mustan jäännöksen, joka säilytti useita kuukausia. Tähän lisätty hiekka ja lämmitti sitä, kaasujen ja öljyjen poistaminen. Lopuksi hän sai valkoisen kiinteän aineen, joka loisti pimeässä vihreällä värillä, jota hän kutsui "kylmäksi tulipaloksi".
Termi 'fosfori', sattumalta tulee kreikkalaisesta sanasta "fosforit", mikä tarkoittaa valon kantajaa.
Brand ei julkaissut kokeellisia tuloksiaan ja myi sen useille alkemistille, mukaan lukien: Johann Kraft, Kerckel Lowenstern ja Wilhelm Leibniz. Todennäköisesti jotkut heistä ilmoittivat tuotemerkin työstä Pariisin tiedeakatemialle, levittäen siten heidän tutkimuksensa.
Brändi ei kuitenkaan todella eristänyt fosforia, vaan ammoniakkinen natriumfosfaatti [NH (NH4) PO4-. Vuonna 1680 Robert Boyle paransi brändin menettelyä, jonka kautta hän voisi saada fosforin alotrooppisen muodon (P4-A.
Luissa
Johan Gottlieb Gahn ja Carl Wihelm Scheele perustivat vuonna 1769, että fosforiyhdiste, kalsiumfosfaatti, oli luissa. Valitetuille luille tehtiin ruuansulatusprosessi, jolla oli vahvoja happoja, kuten rikkihappo.
Sitten ruuansulatustuote lämmitettiin teräsastioissa, joissa oli hiiltä ja hiiltä, mikä sai valkoisen fosforin tislaamalla retortissa. Luut olivat päälähde, joka sai fosforia vuoteen 1840 asti, jolloin guano korvasi ne tätä tarkoitusta varten.
Guanossa
Guano on lintulintujen ja hajotustuotteiden sekoitus. Sitä käytettiin fosforin ja lannoitteiden lähteenä 1800 -luvulla.
- Teollinen kehitys
Fosfaattikiviä käytettiin vuonna 1850 fosforilähteenä. Tämä yhdessä James Burges Readmanin (1888) kallioiden keksimisen kanssa keksimään fosfaattiset kivet fosforin tuotannon ja lannoitteiden pääaineistoksi.
Vuonna 1819 perustettiin Cerrillas -tehtaat, jotka aloittivat fosforin teollisen kehityksen.
Fysikaaliset ja kemialliset ominaisuudet
Ulkomuoto
Allotrooppisesta muodosta riippuen se voi olla väritön, suljettu valkoinen, keltainen, scarlet, punainen, violetti tai musta.
Atomipaino
30 973 u
Atominumero (z)
viisitoista
Sulamispiste
Valkoinen fosfori: 44,15 ºC
Punainen fosfori: ~ 590 ºC
Kiehumispiste
Valkoinen fosfori: 280,5 ºC
Tiheys (ympäristön lämpötila)
Valkoinen: 1 823 g/cm3
Punainen: 2,2-2,34 g/cm3
Violetti: 2,36 g/cm3
Musta: 2,69 g/cm3
Sulamislämpö
Valkoinen fosfori: 0,66 kJ/mol
Höyrystyslämpö
Valkoinen fosfori: 51,9 kJ/mol
Molaarinen kalorikapasiteetti
Valkoinen fosfori: 23 824 J/(mol.K)
Hapetustilat
-3, -2, -1, +1, +2, +3, +4 ja +5
Riippuen niiden elementtien elektronegatiivisuudesta, joiden kanssa fosfori voi näyttää hapetustilaa +3 tai -3. Fosfori, toisin kuin typpi, pyrkii reagoimaan edullisesti hapetustilan +5 kanssa; Näin on fosforipentoksidi (P2JOMPIKUMPI5 tai p25+JOMPIKUMPI52+-A.
Voi palvella sinua: Liukoiset materiaalitElektronegatiivisuus
2,19 Pauling -asteikolla
Ionisaatioenergia
-Ensimmäinen: 1.101 kJ/mol
-Toiseksi: 2.190,7 kJ/mol
-Kolmas: 2.914 kJ/mol
Lämmönjohtokyky
Valkoinen fosfori: 0,236 W/(M · K)
Musta fosfori: 12,1 w/(m · k)
Se osoittaa, kuinka musta fosfori johtaa melkein kuusi kertaa enemmän lämpöä kuin valkoinen fosfori.
Magneettinen järjestys
Valkoinen, punainen, violetti ja mustat ottelut ovat diamagneettisia.
Isotoopit
Fosforilla on 20 isotoopia, jotka ovat tärkeimpiä: 31P, ainoa vakaa isotooppi, jonka runsaus on 100%; 32P, emitter β -isotooppi- ja puoli -elämä 14,28 päivää; ja 33P, β -emitterin isotooppi- Ja puoli -elämää 25,3 päivää.
Fosforesenssi
Valkoinen fosfori on fosforoi ja emittoi vihreän valon pimeässä.
Allotrooppiset muutokset
Valkoinen fosfori on epävakaa ja muuttuu lämpötiloihin, jotka ovat lähellä 250 ºC: ta polymeerimuotoon, joka tunnetaan punaisena fosforina, joka voi vaihdella oranssista violetista oranssista. Se on amorfinen aine, mutta siitä voi tulla kiteistä; Ei loista pimeässä tai palovammassa ilmassa.
Valkoinen fosfori korkeissa lämpötiloissa ja paineissa tai katalyyttien läsnä ollessa transformoituna muuhun polymeeriseen muotoon kuin punaiseksi fosforiksi: musta fosfori. Tämä on musta, inertti kiteinen aine, samanlainen kuin grafiitti, ja sillä on kyky johtaa sähköä.
Liukoisuus
Valkoinen fosfori puhdas on liukenematon veteen, vaikka se voidaan liuottaa hiilisulfidiin. Samaan aikaan punaiset ja mustat ottelut ovat liukenemattomia veteen ja ovat vähemmän haihtuvia kuin valkoinen fosfori.
Reaktiivisuus
Fosfori palaa spontaanisti ilmassa P: n muodostamiseksi2JOMPIKUMPI5, Ja tämä puolestaan voi reagoida kolmen vesimolekyylin kanssa ortofosforin tai fosforihapon muodostamiseksi (H3Poikki4-A.
Kuuman veden vaikutuksella on fosfiinia (pH3) ja fosforioksasidit.
Fosforihappo vaikuttaa fosfatoiduihin kiviin aiheuttaen dihydyä tai superfosfaatti kalsiumfosfaattia [CA2Poikki4-A2-.
Voit reagoida halogeenien kanssa PX -halogenien muodostamiseksi3, edustaa X: lle F, Cl, BR tai I; o Haluros PX -kaavalla5, Olla x, cl tai br.
Myös fosfori reagoi metallien ja metalloidien kanssa aiheuttaen fosfideja ja rikki muodostaa useita sulfideja. Toisaalta se sitoutuu happea lähtemään estereitä. Samoin se yhdistetään hiilen kanssa fosforin orgaanisten yhdisteiden muodostamiseksi.
Elektroninen rakenne ja kokoonpano
- Linkit ja tetraedrinen yksikkö
Fosforiatomeilla on seuraava elektroninen kokoonpano:
[Ne] 3s2 3P3
Siksi viisi Valenciasta peräisin olevaa elektronia, kuten typpi ja muut ryhmän 15 elementit. Koska se on ei -metallinen elementti, sen atomien on muodostettava kovalenttisia sidoksia, kunnes Octeto de Valencia on valmis. Typpi saavuttaa sen, kun se on perustettu datamic -molekyyleiksi n2, Kolminkertaisella linkillä, nÖn.
Sama pätee fosforiin: kaksi sen p -atomia on kytketty kolminkertaiseen sidokseen P -molekyylin muodostamiseksi2, P≡P; Tämä on difosforin alotrope. Fosforilla on kuitenkin suurempi atomimassa kuin typellä, ja sen 3p -kiertoradalla, diffuusi kuin typen 2p, päällekkäin vähemmän tehokkuudella; Siksi p2 Se on vain kaasumaisessa tilassa.
Sen sijaan huoneenlämpötilassa atomit P mieluummin järjestävät kovalenttisesti toisella tavalla: tetraedrisessa molekyylissä P4-
 P4 -molekyyliyksiköt valkoisissa fosforikiteissä. Lähde: Benjah-BMM27 Wikipedian kautta.
P4 -molekyyliyksiköt valkoisissa fosforikiteissä. Lähde: Benjah-BMM27 Wikipedian kautta. Huomaa, että ylemmässä kuvassa kaikilla P -atomeilla on kolme yksinkertaista linkkiä kolminkertaisen linkin sijasta. Siten fosfori P: ssä4 Suorita Octeto de Valencia. Kuitenkin p4 P-P-linkkeissä on jännitystä, koska niiden kulmat ovat menossa paljaalle silmiin 109,5 °.
- Alotrooppit
Valkoinen fosfori
Sama kuva P -yksiköistä4 Ja sen epävakaus selittää, miksi valkoinen fosfori on tämän elementin epävakain alotrooppinen.
Yksiköt p4 Ne järjestetään avaruudessa määrittelemään BCC -kide (vaihe α) normaaleissa olosuhteissa. Kun lämpötila laskee -77,95 ºC, BCC -lasi muuttuu HCP: ksi (oletettavasti), tiheämmäksi (β -faasi). Eli P -yksiköt4 Ne on tilattu kahdessa vaihtoehtoisessa kerroksessa, A ja B, ABAB -sekvenssin luomiseksi ..
Punainen fosfori
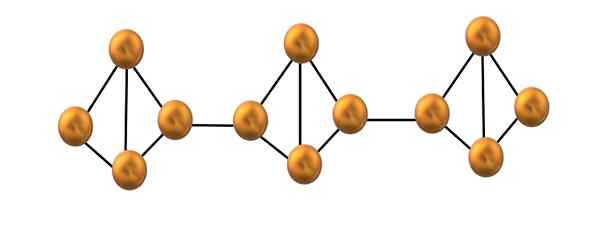 Punainen fosforiketjun rakenne. Lähde: Gabriel Bolívar.
Punainen fosforiketjun rakenne. Lähde: Gabriel Bolívar. Yläkuvassa on esitetty vain pieni segmentti punaisesta fosforirakenteesta. Koska kolme yksikköä on kohdistettu "symmetrisesti", voidaan sanoa, että se on kiteinen rakenne, joka saadaan kuumentamalla tämä fosfori yli 250 ºC.
Punainen fosfori kuitenkin suurimman osan ajasta se koostuu kiinteästä amorfisesta, joten sen rakenne on sotkuinen. Joten P: n polymeeriketjut4 Heillä olisi ilman ilmeistä mallia, yksi yllä ja muut saman tason alapuolella mielivaltaisesti.
Huomaa, että tämä on päävalkoisen ja punaisen fosforin välillä: ensimmäisessä4 Ne ovat yksilöllisiä ja toisessa muodostusketjussa. Tämä on mahdollista, koska yksi P-P-linkistä on rikki tetraedron sisällä, jotta se voi linkittää naapurimaiden tetraedron. Siten rengasmainen jännitys ja punainen fosfori vähenevät enemmän stabiilisuutta.
Voi palvella sinua: sinkki: historia, ominaisuudet, rakenne, riskit, käyttötarkoituksetKun molempia alotrooppeja on sekoitus, sitä tarjotaan näkyvissä keltaisena fosforina; Sekoitus tetraedraa ja amorfisia fosforiketjuja. Itse asiassa valkoinen fosfori.
Violetti tai hittorf -fosfori
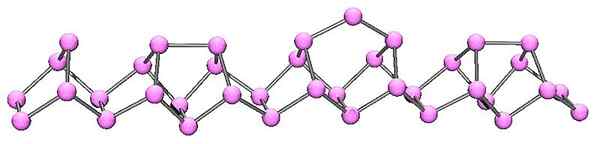 Violetin fosforin molekyylirakenne. Lähde: Kadmium englanniksi Wikipediassa [julkinen verkkotunnus]
Violetin fosforin molekyylirakenne. Lähde: Kadmium englanniksi Wikipediassa [julkinen verkkotunnus] Violetti fosfori on punaisen fosforin viimeinen kehitys. Kuten ylemmässä kuvassa voidaan nähdä, se koostuu edelleen polymeeriketjusta; Mutta nyt rakenteet ovat monimutkaisempia. Näyttää siltä, että rakenneyksikkö ei ole enää p4 mutta p2, järjestetty siten, että ne muodostavat epäsäännöllisiä pentagonaalisia renkaita.
Huolimatta siitä, kuinka epäsymmetrinen rakenne näyttää, nämä polymeeriketjut onnistuvat tilaamaan riittävän hyvin ja määräajoin niin, että violetti fosfori.
Musta fosfori
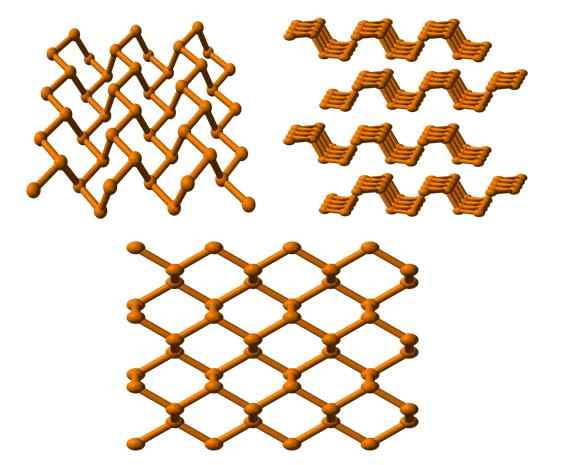 Useista näkökulmista nähty musta fosforirakenne. Lähde: Benjah-BMM27 [julkinen alue].
Useista näkökulmista nähty musta fosforirakenne. Lähde: Benjah-BMM27 [julkinen alue]. Ja lopuksi meillä on vakain fosfori -alotrope: musta väri. Valmistelee valkoisen fosforin 12 paineen alla.000 atm.
Yläkuvassa (alla) voidaan nähdä, että sen rakenteella korkeammasta tasosta muistuttaa tietty grafiitin rakennetta; Se on jyrkkä kuusikulmaisten renkaiden verkko (vaikka ne näyttävät neliömäiseltä).
Kuvan vasemmassa yläkulmassa voit paremmin arvostaa äskettäin kommentoitua. P -atomien molekyyliympäristöt ovat trigonaalisia pyramidia. Huomaa, että rakenteen näkymä sivusuunnassa (oikea yläkulma) on järjestetty kerroksiin, jotka sopivat toiseen.
Mustan fosforin rakenne on melko symmetrinen ja järjestetty, mikä on yhtä mieltä sen kyvystä asettua ortorromisiin kiteisiin. Sen polymeerikerrosten pinoaminen aiheuttaa P -atomeja, joita ei ole saatavana monille kemiallisille reaktioille; Ja siksi se on huomattavasti vakaa ja vähän reaktiivinen.
Vaikka sitä ei ole tarpeen mainita, Lontoon dispersiovoimat ja näiden fosforin kiinteiden aineiden molaariset massot ovat niitä, jotka hallitsevat joitain sen fysikaalisia ominaisuuksia; kun taas niiden rakenteet ja sidokset P-P määrittelevät kemialliset ominaisuudet ja muut.
Missä se on ja saa
Apatita ja fosforiitti
Se on maankuoren kaksitoista elementtiä ja edustaa 0,1% siitä painon mukaan. Fosforia sisältävät mineraalit ovat noin 550 mineraalia, apatita on tärkein mineraali fosforin saamiseksi.
Apatita on fosfori- ja kalsiumin mineraali, joka voi sisältää muuttuvia määriä fluoria, kloridia ja hydroksidia, joiden kaava on seuraava: [CA CA10(PO4-A6(F, Cl tai OH)2). Apatiitin lisäksi on muita kaupallisia fosforimineraaleja; Näin on Wavelita ja Vivianita.
Fosfaatti- tai fosforiittikivi on tärkein fosforilähde. Se on ei-detriittinen sedimenttikivi, jolla on 15-20-prosenttinen fosforipitoisuus. Fosforia on yleensä läsnä CA: na10(PO4-A6F2 (Fluorapatita). Sitä on myös hydroksiapatiitina, vaikkakin vähemmässä määrin.
Lisäksi fluorapatiittia voidaan löytää osaan tuntemattomia ja metamorfisia kiviä, samoin kuin kalkkikiviä ja liuskeja.
Fluorapatitan sähköterminen pelkistys
Valitut fosfaattikivet siirretään käsittelylaitokselle prosessointia varten. Alun perin ne murskataan saadakseen kivifragmentteja, jotka jauhetaan sitten pallomyllyt 70 kierrosta minuutissa.
Sitten kalliofragmenttien jauhamisen tuote on seulottu pystyvän murtumaan ne. Nämä fraktiot valitaan 34 -prosenttisella fosforipitoisuudella, kuten fosforipentoksidilla (P2JOMPIKUMPI5-A.
Valkoinen fosfori (P4) Sitä saadaan teollisesti fluorapatiitin elektrotermisellä vähentämällä hiiltä lämpötilassa 1.500 ºC piisoksidin läsnä ollessa:
2ca3(PO4-A2(S) + 6Sio2(s) + 10 c (s) => p4(g) + casio3(L) + co (g)
P4 Kaasumaisessa tilassa, tiivistyksen jälkeen, se kerätään ja varastoidaan veteen upotettuna valkoisena kiinteänä kiinteänä aineena, joka estää reagoivan ulkoisen ilman kanssa.
Seokset
Kuparinen
Fosfori -kansi on valmistettu eri prosentuaalisilla kuparilla ja fosforilla: Cu 94 % - P 6 %; Cu 92% - P 8%; Cu 85% - P 15% jne. Seosta käytetään deoksidanttina, kosteuttavan aineena kupariteollisuudessa ja myös ytimenä alumiiniteollisuudessa.
Bronsiini
Ne ovat kuparia, fosforia ja tinaseoksia, jotka sisältävät 0,5 - 11% fosforia ja 0,01 - 0,35% tinaa. Tina lisää korroosionkestävyyttä, kun taas fosfori.
Sitä käytetään jousien, pulttien ja yleensä väsymyksen, kulumisen ja kemiallisen korroosion laatimisessa ja yleensä artikkeleissa. Sen käyttöä aluksen potkurissa suositellaan.
Voi palvella sinua: kadmium (CD): historia, ominaisuudet, rakenne, käyttöNictalladas
Tunnetuin seos on nipkaksikymmentä, Käyttämällä fosforoitua nikkeliä vahvoissa hitsausseoksissa parantaakseen sen vastustuskykyä kemialliselle eroosiolle, hapettumiselle ja korkeille lämpötiloille.
Seosta käytetään kaasu- ja reaktiomoottoreissa komponentteja, galvanoplastiaa ja hitsauselektrodien tuotannossa.
Riskejä
Valkoinen fosfori tuottaa vakavaa ihon palovammoja ja on voimakas myrkky, joka voi olla kuolevainen 50 mg: n annoksella. Fosfori estää solujen hapettumista häiritsemällä solun hapenhoitoa, mikä voi johtaa rasvan rappeutumiseen ja solun kuolemaan.
Akuutti fosforimyrkytys tuottaa vatsakivun neljän ensimmäisen päivän aikana, armoria, hengitystä valkosipulin hajulla, fosforoiva oksentelu, hikoilu, lihaskramppit ja jopa shokkitila.
Myöhemmin keltaisuus, petechiae, verenvuoto, sydänlihaksen internetointi rytmihäiriöiden kanssa, keskushermoston muutos ja kuolema kymmenennen saannin päivänä ilmenee.
Kroonisen fosforimyrkytyksen ilmeisin ilmenemismuoto on leuan luurakenteen vaurioita.
Plasmafosforikonsentraation (hyperfospathia) lisääntyminen esiintyy yleensä munuaisten vajaatoimintapotilailla. Tämä aiheuttaa fosfaattien epänormaalin talletuksen pehmytkudoksissa, mikä voi johtaa verisuonten toimintahäiriöihin ja sydän- ja verisuonisairauksiin.
Sovellukset
Fosfori on olennainen osa kasveille ja eläimille. Se on yksi kasvien kolmesta pääravinteesta, jotka ovat välttämättömiä niiden kasvu- ja energian vaatimuksiin. Lisäksi se on osa nukleiinihappoja, fosfolipidejä, metabolisten prosessien välituotteita jne.
Selkärankaisilla fosforia on luissa ja hampaissa hydroksylapatiitin muodossa.
- Perusfosfori
 Laatikko otteluita tai "fosforia". Lähde: Pxhere.
Laatikko otteluita tai "fosforia". Lähde: Pxhere. Fosforin avulla valmistetaan kemiallinen emali, jota käytetään valaisemaan alumiinille ja sen seoksille asetettuja ilmoituksia; samoin kuin kupari ja fosforoitunut pronssi.
Sitä käytetään myös syttyvät pommit, kranaatteja, savupumppuja ja merkkiainetta. Punainen fosforia käytetään turvallisuusottelujen tai otteluiden kehittämisessä.
Valkoista fosforia käytetään organofosfaatin kehittämiseen. Lisäksi sitä käytetään fosforihapon tuotannossa.
Suuri määrä tuotettua fosforia poltetaan fosforittraksidin tuotantoon (P4JOMPIKUMPI10), saatu jauheena tai kiinteänä.
- Yhdisteet
Fosfiini
Se on raaka -aine useiden fosforiyhdisteiden kehittämiseksi. Se toimii elektronisten komponenttien doping -aineena.
Fosforihappo
Sitä käytetään virvoitusjuomien laatimisessa johtuen ominaisesta mausta, joka antaa heille. Toimi fosfaattikivillä dihydrogeenisen kalsiumfosfaatin muodostamiseksi2Poikki4-A2], tunnetaan myös nimellä superfosfaatti, jota käytetään lannoitteena.
Fosforihappo on hammaskemelin elementtien hoitoaine helpottaakseen sen palauttamisen materiaalien tarttuvuutta. Sitä käytetään myös öljyn, urean, tauon, bitumin ja hiekan kanssa asfaltin muodostamiseksi; Maanviestinnän kanavien korjaamisessa käytetty materiaali.
Organoffori
Organofosforiyhdisteillä on lukuisia sovelluksia; kuten: liekinestoaineet, torjunta -aineet, uuttamisaineet, hermovaikutusaineet ja vedenkäsittely.
Dihydraatti dihydraatti kalsiumfosfaatti
Sitä käytetään lannoitteena, leivinjauheena, eläinruoka -lisäaineena ja hammaspastaten kehittämisessä.
Fosforipentoksidi
Sitä käytetään kemiallisessa analyysissä kuivausaineena ja orgaanisessa synteesissä lauhduttimena. Yhdiste on osoitettu pääasiassa ortofosforihapon tuotantoon.
Natrium -tripolyfosfaatti
Sitä käytetään pesuaineissa ja vedenpehmennyksenä, mikä parantaa pesuaineiden vaikutusta ja auttaa välttämään putkien korroosiota.
Trisodinen fosfaatti
Sitä käytetään puhdistusaineena ja vedenpehmennyksenä.
Natriumfosfaatit
Dibasinen natriumfosfaatti (NA2HPO4) ja monobasinen natriumfosfaatti (NAH2Poikki4) ovat pH -iskunvaimenninjärjestelmän komponentteja, jotka toimivat jopa elävissä olennoissa; Heidän joukossaan ihmisiä.
Viitteet
- Reid Danielle. (2019). Fosforin allotroopit: muodot, käyttö ja esimerkki. Opiskelu. Toipunut: Opiskelu.com
- Prof. Robert J. Lancashire. (2014). Luento 5C. Elementtien rakenne, jatka p, s ja i. Palautettu: Chem.Uwimona.Edu.JM
- Byju. (2019). Fosforipunainen. Toipunut: byjus.com
- Bing Li, Ceng-Ceng Ren, Shu-Feng Zhang, et ai. (2019). Monikerroksisen sinisen fosforin elektroniset rakenteelliset ja optiset ominaisuudet: Ensimmäisen periaatteen tutkimus. Journal of Nanomaterials, vol. 2019, artikkeli ID 4020762, 8 sivua. doi.org/10.1155/2019/4020762
- DR. Taikina. (2019). Fosforielementit tosiasiat. Kemikooli. Toipunut: Chemicool.com
- Wikipedia. (2019). Fosfori. Haettu: vuonna.Wikipedia.org
- Helmestine, Anne Marie, PH.D -d. (3. heinäkuuta 2019). Fosforitiedot (atominumero 15 tai elementti P). Toipunut: Admingco.com
- Linus Pauling Institute. (2019). Fosfori. Toipunut: LPI.Oregonstate.Edu
- Bernardo Fajardo p. & Héctor Lozano V. (S.F.-A. Kansallinen fosforikiviprosessointi superfosfaattituotannossa. [PDF]. Palautettu: bdigital.I-kirjain.Edu.yhteistyö
- Enyclopaedia Britannica -toimittajat. (16. marraskuuta 2018). Fosforikemiallinen elementti. Encyclopædia britannica. Toipunut: Britannica.com
- Reade International Corp. (2018). Kuparifosfori (kuppi) seos. Palautettu: Reade.com
- KBM Affilips. (27. joulukuuta 2018). Nikkelifosforin (NIP) mestari -seos. Atsom. Toipunut: Azom.com
- Lentech b.V. (2019). Aikataulukko: Fosfori. Toipunut: lentech.com
- Abhijit naik. (21. helmikuuta 2018). Fosforin käyttö. Toipunut: Sciencestruck.com
- « Manometrinen paine selitys, kaavat, yhtälöt, esimerkit
- Trincheras -kulttuurin alkuperä, ominaispiirteet, uskonto, kulttuuri »

