Van der Waals -voimat
- 2102
- 144
- Louis Moen
Selitämme, mitkä van der waalit ovat voimat, niiden ominaisuudet, tyypit ja antavat esimerkkejä kussakin
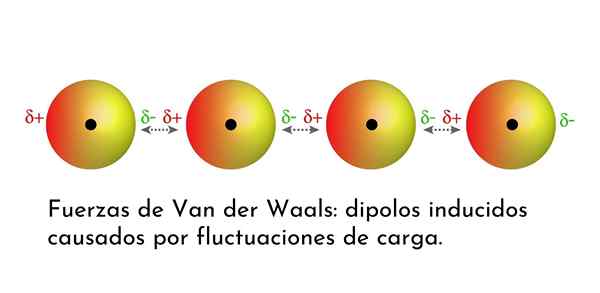
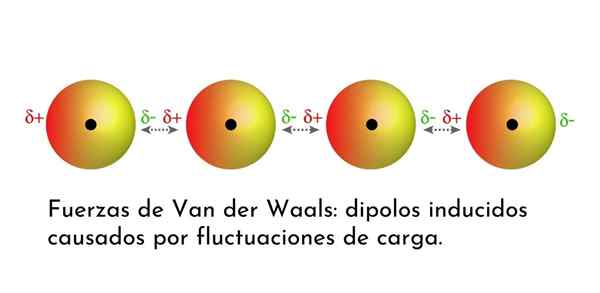 Kuva, joka näyttää yhden van der Waalsin voimien tyypistä, Lontoon dispersiovoimat, useiden atomien keskuudessa välittömällä dipolilla
Kuva, joka näyttää yhden van der Waalsin voimien tyypistä, Lontoon dispersiovoimat, useiden atomien keskuudessa välittömällä dipolilla Mitkä ovat van der Waalsin voimat?
Se Van der Waals -voimat Ne ovat joukko lyhytaikaisia vetovoimavoimia kaikkien atomien ja molekyylien välillä. He saavat nimensä hollantilaisen tutkijan Johannes Diderik van der Waalsin kunniaksi.
Nämä voimat ovat suhteellisen heikkoja, mutta ne ilmestyvät koko kontaktipinnalle kahden atomin välillä, kahden molekyylin välillä tai kahden pinnan välillä, joten jos mainittu kosketuspinta on suuri, van der Waalsin voimat voivat tulla huomattaviksi.
Van der Waalsin voimien ymmärtäminen mahdollistaa kvalitatiivisesti ennustamisen kemiallisten aineiden monia fysikaalisia ominaisuuksia, kuten niiden sulamis- ja kiehumispisteitä ja liukoisuutta erityyppisissä liuottimissa. Nämä ovat voimia, jotka sallivat selittää, kuinka on mahdollista, että monoatomikaasu, kuten helium, joka ei muodosta minkäänlaista kemiallista sidosta, voi tiivistää ja siirtyä nestetilaan.
Nämä voimat selittävät myös, miksi aine, kuten vesi, joka muodostuu molekyyleistä, joiden molaarimassa on vain 18 g/mol, on nestemäinen, kun taas kloori, joka painaa melkein 4 kertaa enemmän, on kaasu huoneenlämpötilassa.
Van der Waals -voimien ominaisuudet
Atomien ja molekyylien välisen vetovoimavoiman esittämisen lisäksi Van der Waalsin voimilla ei ole monia ominaisuuksia kemiallisten sidosten kanssa. Seuraavaksi esitetään tämän tyyppisten voimien merkittävimmät ominaisuudet:
- Ne ovat etäisyydestä riippuvaisia voimia. Yksinkertaisimmassa tapauksessa ne vähenevät etäisyyden neliön kanssa. Lisäksi ne riippuvat voimakkaasti molekyyligeometriasta.
- Verrattuna ionisissa, kovalenttisissa ja metallisissa yhteyksissä esiintyviä vetovoimavoimia, van der Waalsin voimat ovat suhteellisen heikot.
- Lukuun ottamatta dipoli-dipolo-vuorovaikutuksia, ne ovat riippumattomia lämpötilan vuorovaikutuksia.
- Ne ovat lyhytaikaisia voimia, mikä tarkoittaa, että ne vähenevät nopeasti, kun atomit ja molekyylit liikkuvat pois.
- Ne ovat yleisiä voimia, joita tapahtuu minkä tahansa atomin ja minkä tahansa molekyylin välillä.
- Toisin kuin kovalenttiset sidokset, niillä ei ole suuntausta. Tämä tarkoittaa, että riippumatta siitä, kuinka suuntautumisesta kaksi molekyyliä lähestyy, jos ne lähestyvät tarpeeksi, van der Waalsin voimat ilmestyvät aina.
- Kun kaksi molekyyliä tai atomia lähestyy liikaa, voima muuttuu torjumaan, mikä estää molekyylejä romahtamasta toisiaan.
- Ne ovat additiivisia, mikä tarkoittaa, että huolimatta huomattavasti heikoista, monien samanaikaisten vuorovaikutusten olemassaolo voi aiheuttaa kokonaisen vetovoiman voiman huomattavan.
Van der Waals -voimien tyypit
Kiertävän komponentin lisäksi, joka varmistaa, että atomit ja molekyylit eivät romahta, van der Waals -voimia on kolmen tyyppisiä, jotka voivat toimia samanaikaisesti kahden molekyylin tai atomin välillä. Nämä on esitetty alla:
1. Dipolo-dipolo-vuorovaikutukset tai Keesom-voimat
Keesomin vahvuus on yksi veronmaksajista van der Waalsin voimaan. Nämä ovat sähköstaattisia vuorovaikutusvoimia, jotka esiintyvät polaaristen molekyylien, kuten vesi, asetoni ja muut, pysyvien dipolien keskuudessa.
Keesomin voimat ovat samanlaisia kuin ionien välissä sähköstaattiset voimat, mutta eroaa niistä, koska ne ovat paljon heikompia ja rappeutuvat kuudennen etäisyyden voimalla (ts. R: n kanssa R: llä6-A. Syynä siihen, miksi ne ovat heikompia.
Nämä vuorovaikutukset annetaan vain molekyylien välillä eikä atomien välillä, koska atomeilla ei ole pysyviä dipolimomentteja. Lisäksi Keesomin voima on käänteisesti verrannollinen lämpötilaan, mikä tarkoittaa, että Keesomin voima vähenee, kun se kasvaa.
Esimerkkejä molekyyleistä, joilla on dipoli-dipolo-vuorovaikutuksia
Kaikilla polaarisilla molekyyleillä on dipoli-dipolin vuorovaikutuksia niiden välillä. Esimerkiksi:
- Kaksi asetonimolekyyliä.
- Kaksi kloroform -molekyyliä.
- Sykloheksanonimolekyyli, jolla on asetonimolekyyli.
2. Indusoidut dipolo-dipolo-vuorovaikutukset tai Debye-joukot
Kun polaarinen molekyyli lähestyy atomia tai apolaarista molekyyliä, ensimmäisen dipoli houkuttelee tai toistaa elektroneja toisen pinnalla. Tämä indusoi dipolin apolaarisessa molekyylissä, jota kutsutaan indusoiduksi dipoliksi. Uusi dipoli muodostui ja on sitten vuorovaikutuksessa alkuperäisen dipolin kanssa, joka luo pienen vetovoiman voiman.
Voi palvella sinua: palamislämpöNämä pysyvän ja indusoidun dipolin väliset vuorovaikutukset tunnetaan yleensä Debye -voimina, ja ne riippuvat paitsi kahden molekyylin välisestä etäisyydestä tai polaarisen molekyylin ja yksittäisen atomin välillä, mutta myös riippuvat apolaarisen molekyylin polarisoituvuudesta ja suuruudesta polaarimolekyylin dipolimomentti.
Esimerkkejä molekyyleistä, jotka ovat indusoineet dipoli-dipolin vuorovaikutuksia
Tällainen vuorovaikutus annetaan vain eri molekyylien välillä, koska toisen on oltava polaarinen ja että toinen ei. Joitakin esimerkkejä ovat:
- Jalokaasun, kuten argonin ja polaarisen yhdisteen, atomi, kuten vetykloridi. Tässä tapauksessa positiivinen osittainen kuormitus HCL -vedyssä houkuttelee argonin valencia -elektroneja, mikä tuottaa pienen dipolin, joka on indusoitu viimeksi mainitussa. Jos argoni lähestyy klooriatomia, negatiivinen osittainen kuorma torjuu myös valenssielektronit ja muodostetaan myös indusoitu dipoli.
- Molekyylibromaatti (BR2) Se on huomattavasti liukoinen veteen huolimatta siitä, että se on apolaarinen yhdiste ja voimakkaasti polaarisen liuottimen vesi. Selitys johtuu osittain bromin korkeasta polarisoituvuudesta, jonka avulla voit muodostaa huomattavasti vahvoja vuorovaikutuksia.
3. Indusoidut dipolo-dipolon aiheuttamat vuorovaikutukset tai Lontoon dispersiovoimat
Kaikista van der Waalsin joukkoista heikoimmat ovat Lontoon hajauttamisvoimat. Nämä vuorovaikutukset annetaan kaikkien atomien ja molekyylien välillä välittömien dipolien esiintymisen vuoksi niiden rakenteen missä tahansa osassa.
Välitön dipoli on pieni dipoli, joka muodostuu valenssielektronien epäsymmetrisellä jakautumisella tietyllä hetkellä.
Voi palvella sinua: tyydyttymättömät hiilivedytKuinka välittömiä dipoleja syntyy?
Kun elektronit pyörivät ytimen ympärillä, voi tapahtua, että toisella puolella on enemmän elektroneja kuin toiselta, mikä aiheuttaa dipolin. Tämä pieni dipoli katoaa nopeasti, kun elektronit edelleen liikkuvat ytimen ympäri, ja siksi niitä kutsutaan tilannekuviksi.
Välittömiä dipoleja voi syntyä missä tahansa molekyylin rakenteessa ja milloin tahansa niitä voi olla monia. Lontoon dispersiovoimat koostuvat näiden hetkellisten aikojen välisestä vuorovaikutuksesta yhdessä molekyylissä ja toisen.
Esimerkkejä yhdisteistä, joissa on Lontoon dispersiovoimat
Kuten mainittiin, tämän tyyppiset vuorovaikutukset tapahtuvat kaikkien atomien ja molekyylien välillä. Kuitenkin suurissa apolaarisissa molekyyleissä, joissa sen vaikutusta voidaan havaita paremmin, koska näissä tapauksissa tapahtuu ainoa tyyppinen molekyylien välinen vuorovaikutus.
Tyypillinen esimerkki, jossa nämä voimat ovat erittäin voimakkaita, on pitkän ketjun alifaattisten hiilivetyjen tapauksessa, etenkin polymeereissä, kuten polyeteeni.

