Molekyylien väliset voimat
- 3207
- 745
- Kelly Kilback
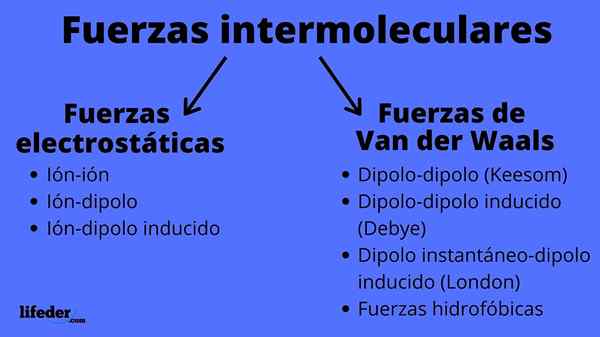
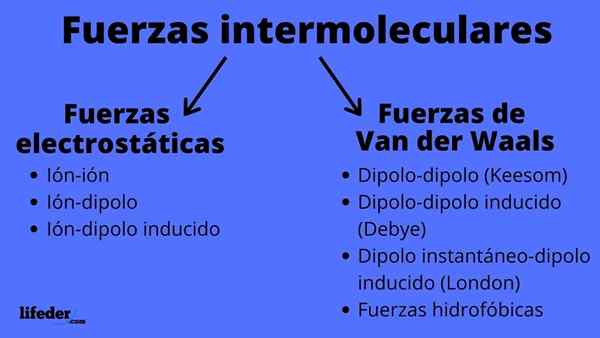 Molekyylien välisten voimien tyyppien kaavio
Molekyylien välisten voimien tyyppien kaavio Mitkä ovat molekyylien väliset voimat?
Se Molekyylien väliset voimat Ne ovat joukko vuorovaikutuksia, jotka tapahtuvat molekyylien välillä, riippumatta siitä, onko sama kemiallinen yhdiste vai ei, ja ne pitävät niitä yhdessä. Näiden voimien ansiosta molekyylit onnistuvat ryhmittelemään ja määrittelemään kiinteän, nesteen tai kaasun; Eli ne ovat vastuussa aineiden fysikaalisista ominaisuuksista.
Molekyylien väliset voimat voivat olla kahta tyyppiä: sähköstaattiset tai van der waalit. Sähköstaattiset ovat kaikki niitä, joissa meillä on ionit, jotka ovat sähköisesti ladattuja atomeja tai molekyylejä (+ tai -). Samaan aikaan van der Waalsin aiheita sisältyy neutraaleja atomeja tai molekyylejä, jotka niiden elektronisen jakauman vaihteluilla polarisoidaan ja houkuttelevat tai hylätään toistensa kanssa.
Molekyylien välisiä voimia voidaan verrata olemassa olevaan ammattiliittoon maallikkojen eri kappaleiden välillä. Niiden muodoista ja ohjeista riippuen heidän ammattiliitot heikentyvät tai heikentyvät, aivan kuten ne muuttavat rakennusten suunnittelua ja lopullisia ulottuvuuksia.
Mitä voimakkaammat nämä voimat ovat, sitä vaikeampaa on erottaa maallikot tai kemian tapauksessa molekyylit. Tämä tarkoittaa myös sitä, että tiivistymisessä on suurempi ja että siksi molekyylit määrittelevät enemmän viskoosisia nesteitä, raskaampia tai tiheämpiä kaasuja.
Muut fysikaaliset ominaisuudet, kuten fuusio- ja kiehumispisteet, volatiliteetti, rakenne jne., Ne ovat myös molekyylien välisten voimien makroskooppisia refleksejä, jotka hallitsevat yhdisteen tai seosten molekyylien tai ionien välillä. Esimerkiksi: Kaasujen molekyylien väliset voimat ovat erittäin heikkoja verrattuna kivin voimiin.
Molekyylien välisten voimien ymmärtäminen on välttämätöntä monien kemiallisten, fysikaalisten ja biologisten käsitteiden kuvaamiseksi.
Sähköstaattiset voimat
Ioni-ioni
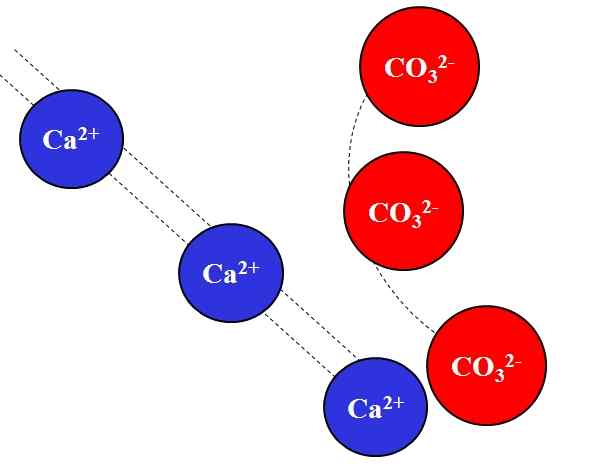 Sähköstaattinen vetovoima CA2+: n ja CO32 -ionien välillä-. Lähde: Gabriel Bolívar.
Sähköstaattinen vetovoima CA2+: n ja CO32 -ionien välillä-. Lähde: Gabriel Bolívar. Vastakkaiset maksut ionit houkuttelevat suurella voimalla, mikä johtuu Coulombin laista, ja vähenee nopeasti, sitä enemmän ionit liikkuvat pois.
Esimerkiksi Ca -ioni2+ Se on positiivinen varaus, kationi, kun taas CO32- Se on negatiivinen kuormitus -ioni, anionin. Koska olet vastakkainen kuorma, Kalifornia2+ ja yhteistyökumppani32- He houkuttelevat toisiaan osoittaen, että mitä lähempänä he ovat, sitä enemmän he pysyvät.
Päinvastoin, ionit, joilla on sama kuorma, olipa ne positiivinen tai negatiivinen, torjuvat samalla voimalla, mutta päinvastaisessa merkityksessä. Siten CA2+ Hylätä ioneille, kuten na+, Mg2+, K -k -+, jne., ellei ole muita anioneja, jotka vähenevät torjumista.
Se voi palvella sinua: Dibenzalacetona: Ominaisuudet, reaktiomekanismi, käyttö, riskitKaikista molekyylienvälisistä voimista ioni-ionityypin voimat ovat yksinkertaisin; Mutta samaan aikaan vahvinta kaikista. Ionien erottamiseksi tarvitaan paljon energiaa tai lämpöä.
Ion-dipolo
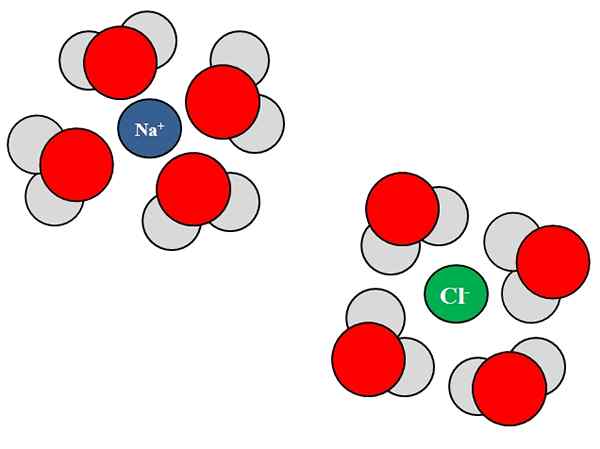 Vesimolekyylien ja NaCl-ionien väliset ion-dipolo-vuorovaikutukset. Lähde: Gabriel Bolívar.
Vesimolekyylien ja NaCl-ionien väliset ion-dipolo-vuorovaikutukset. Lähde: Gabriel Bolívar. Ionit voivat myös olla vuorovaikutuksessa neutraalien atomien tai molekyylien, kuten veden kanssa. Tämä pätee erityisesti, kun kyse on liuottimen molekyyleistä, jotka Solvata, ts.
Esimerkiksi natriumkloridi, NaCl, koostuu Na -ioneista+ ja cl-. Kun niiden kiteet heitetään veteen, vesimolekyylit, H2O tai hoh, hydraatti tai ympäröi NaCl: n ionit; Mutta tapa, jolla ne tekevät, vaihtelee kyseisestä ionista riippuen.
Siten näemme ylemmässä kuvassa, että ion na+ on hydratoitunut H H -happiatomilla2JOMPIKUMPI. Samaan aikaan ion CL- hydratoitu vetyatomilla.
Koska? Koska vesi on polaarista ainetta, mikä tarkoittaa, että siinä on dipoli: napa, jolla on positiivinen osittainen kuorma, ja toinen negatiivinen osittainen kuorma.
Happiatomi, koska se on elektronegatiivisempi, houkuttelee elektroneja itseään kohti, etsimällä elektroneja useammin kyseisen atomin ympärille; jotain, joka ei tapahdu samalla tavalla vetyatomien kanssa, vähemmän elektronegatiivista. Happi, koska se on negatiivisempi, on suunnattu NA: lle+; Vaikka hydrogenssit, koska ne ovat positiivisempia, ovat suunnattu CL: hen-, Koska vastakkaiset maksut ovat houkutelleet.
Indusoitu ion-dipolo
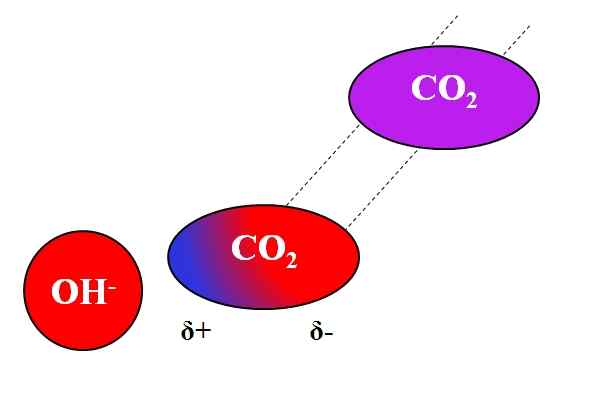 Induktiivinen vaikutus OH- Molekyylissä. Lähde: Gabriel Bolívar.
Induktiivinen vaikutus OH- Molekyylissä. Lähde: Gabriel Bolívar. Ei vain polaarisia tai dipolesimolekyylejä voi olla vuorovaikutuksessa ionien kanssa. Neutraalien atomien tai molekyylien kohdalla, vaikka niillä ei olisi dipoleja, niiden elektronien jakautuminen on alttiita läheisten ionien induktiivisille vaikutuksille; Eli ionit aiheuttavat hetkellisen ja lyhyen polarisaation, tarpeeksi huomattavaa vuorovaikutusta varten.
Voi palvella sinua: lyijyasetaatti: rakenne, ominaisuudet, hankkiminen, käyttöOletetaan esimerkiksi OH -ionin välinen vuorovaikutus- ja co2. Yhteistyökumppani2 Se on neutraali yhdiste, jonka molekyylistä (violetissa) puuttuu dipoli. Kuitenkin OH lähestyy-, Tämän negatiivinen kuorma hylkää CO: n happiatomien elektronit2.
Mitä lähempänä OH ovat- ja co2, Vahvempi on torjuminen. Tämän seurauksena OH: n indusoima dipoli alkaa perustaa- Tietoja yhteistyökumppanista2. Positiivinen napa näyttää Δ+, koska elektronit, jotka hylkivät, "muuttavat" molekyylin toiseen päähän.
Siten, oi- ja co2 Ne pysyvät tarpeeksi yhdessä reagoidakseen keskenään. Tästä syystä CO2 Se on erityisen liukoinen alkalisiin ratkaisuihin.
Van der Waals -voimat
Van der Waalsin voimat viittaavat periaatteessa vain ne, jotka ovat neutraalien atomien tai molekyylien välillä, ilman ionisia kuormia.
Dipolo-dipolo (Keesom)
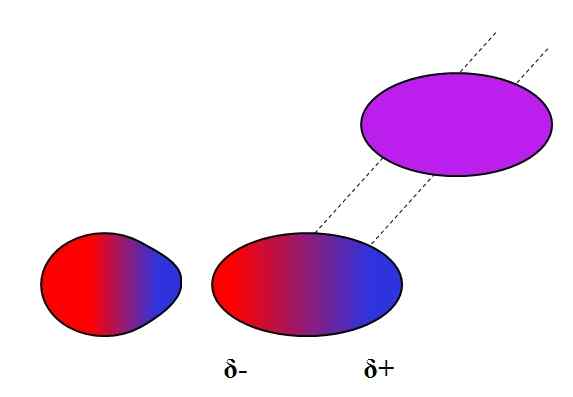
 Dipolo-dipolo-joukot. Lähde: Gabriel Bolívar.
Dipolo-dipolo-joukot. Lähde: Gabriel Bolívar. Vastakkaiset maksut houkuttelevat, yhtä suuret kuormat torjuvat. Sama pätee dipoleihin: vastakkaiset navat (Δ+ ja Δ-) houkuttelevat, kun taas yhtä suuret puolalaiset hylkäävät. Positiiviset pylväät tai Δ+ on esitetty yllä sinisellä värillä, mutta negatiiviset pylväät tai Δ- esitetään punaisella värillä.
Huomaa, kuinka ylimmät molekyylit ovat suunnattuja ja tilattuna siten, että vastakkaiset puolalaiset ovat, siirtymällä prosessissa samoihin napoihin. Tämä tilaaminen tunnetaan vuorovaikutuksina tai voimina dipolo-dipolo (Keesom-voimat) ja ovat tärkeimmät molekyylien väliset voimat polaaristen molekyylien välillä.
Esimerkiksi H -molekyylit2Tai HCL, HF, CO, muun muassa ne tilataan samanlaisissa tilassa. Mitä enemmän polaarisia he ovat, sitä vahvempia sen dipoli-dipolovoimat ovat; Ja siksi vaikeampaa on erottaa heidän molekyylit.
HF on polaarisempi kuin HCl, joten HF: n kiehumispiste on parempi (19.5 ºC) HCL: ään (-85.05 ºC). On uskomatonta vaikutusta, joka molekyylien välisissä voimissa on fysikaalisia ominaisuuksia. Pienin variaatio ja aine käyttäytyvät täysin erilaisiksi kuin mitä odotettiin.
Voi palvella sinua: Kaasumainen tila: Ominaisuudet, yleinen laki, esimerkkejäIndusoitu dipolo-dipolo (Debye)
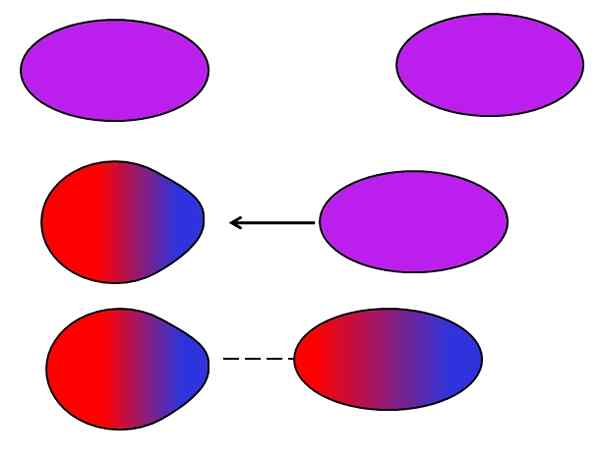
 Indusoitu dipolo-dipolo. Lähde: Gabriel Bolívar.
Indusoitu dipolo-dipolo. Lähde: Gabriel Bolívar. Dipolos, kuten ionit, voi myös vaihdella tai vaikuttaa neutraalien atomien tai molekyylien elektroniseen jakautumiseen. Siksi näemme ylemmässä kuvassa, että dipoli polarisoi yhtäkkiä neutraalin molekyylin. Siksi sanotaan, että se on indusoitu dipoli-dipolivoima, koska toinen dipoli on hetkellinen, ei pysyvä.
Esimerkiksi vesi pystyy liuottamaan pienen määrän tai2, Mutta tarpeeksi meren eläimistöä hengittämään. Jos h2Tai ei voinut indusoida dipolia O: ssa2, Kaikki meren happi pääsisivät pintaan, koska molempien molekyylien välillä ei olisi vuorovaikutusta.
Instant Dipolon indusoima Dipolo (Lontoo)
 Lontoon joukot. Lähde: Gabriel Bolívar.
Lontoon joukot. Lähde: Gabriel Bolívar. Neutraalit atomit tai molekyylit eivät tarvitse naapuri -ioneja tai dipoleja kärsiäkseen itsestään vaihtelusta niiden sisäisten kuormitusten jakautumisessa. Elektronit eivät ole vielä, mutta liikkuvat koko molekyylissä. Jossain vaiheessa tapahtuu välitön dipoli, joka, jos se on hyvin lähellä neutraalia molekyyliä tai atomia, indusoi dipolin (katso yllä).
Mitä suurempi ja epäsymmetrinen nämä molekyylit, sitä todennäköisemmin välittömät dipolit tapahtuvat. Siksi korkeimpien atomimassojen yhdisteillä on indusoitu välitön dipolivoimien aiheuttama intensiivinen. Tämäntyyppiset van der Waals -voimat tunnetaan paremmin Lontoon voimina.
Esimerkiksi jalokaasut (He, NE, AR jne.) Ne pysyvät yhtenäisinä Lontoon joukkojen ansiosta, aivan kuten ilmakaasut (tai2, N2, Yhteistyö2, jne.-A. Tämä voima on myös hallitsevin hiilivetyjen, kuten metaanin, Cho4, Ja propaani, Cho3CH2CH3.
Hydrofobiset voimat
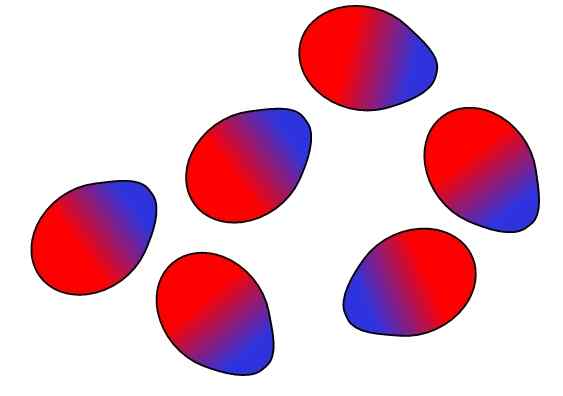
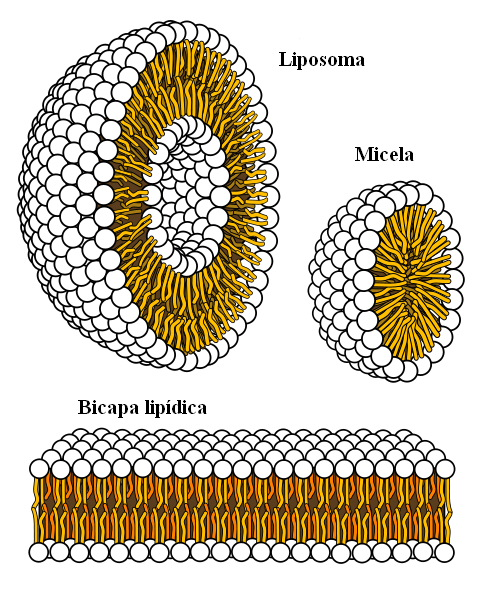 Supramolekulaariset rakenteet ovat peräisin hydrofobisista voimista
Supramolekulaariset rakenteet ovat peräisin hydrofobisista voimista Lopuksi meillä on hydrofobisia voimia, jotka ovat erityinen tulos Lontoon voimista ja vääristymisistä eri napaisuuksilla. Rasvat liittyvät vähän veteen, joten se on liukenematon tässä.
Rasvamolekyylit pyrkivät ryhmittelemään siten, että niiden vuorovaikutus veden kanssa ovat mahdollisimman paljon, ja tämä onnistuu muodostamaan 3D -rakenteet, kuten yllä esitetyt.
Siten rasvamolekyylit, kuten fosfolipidit, kokoontuvat lipidikaksoiskerrosten, misellien ja liposomien muodostamiseksi.
Jos havaitaan, näillä molekyyleillä on valkoinen pää, joka edustaa polaarista osaa, joka liittyy veteen; samoin kuin apolaarinen häntä, joka hylkää vesimolekyylit. Linjat pyrkivät sijoittamaan itsensä näiden supramolekulaaristen rakenteiden sisälle, jotta ne eivät ole vuorovaikutuksessa veden kanssa.

