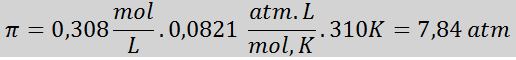Ratkaisujen kolgatiiviset ominaisuudet
- 2468
- 200
- Shawn Stanton II
Mitkä ovat kolgatiiviset ominaisuudet?
Se Kolligatiiviset ominaisuudet, Ne ovat myös liuosten kollektiivisia ominaisuuksia, ne ovat neljän ominaisuuden ryhmä, joka riippuu pelkästään liuoksessa olevien hiukkasten määrästä, mutta eivät näiden hiukkasten luonteesta.
Toisin sanoen nämä ominaisuudet johtuvat muiden hiukkasten kuin liuottimen, toisin sanoen liuenneen aineen hiukkasten läsnäolosta, mutta eivät ole riippuvaisia siitä, kuka liuenneen aineen on. Minkä tahansa tyyppiset hiukkaset voivat aiheuttaa kolongisia ominaisuuksia riippumatta siitä, onko kyse atomeista, ioneista tai molekyyleistä. Ainoa asia, jolla on merkitystä, on keskittymäsi.
Kolgatiiviset ominaisuudet ovat neljä:
- Liuottimen höyrypaineen päätös
- Ebullloskooppinen korkeus
- Kriokooppinen laskeutuminen
- Osmoottinen paine
Kaikille on ominaista olla verrannollinen liuenneen aineen pitoisuuteen suhteellisen laimennettujen liuosten tapauksessa (konsentraatio <0,2 M). Para soluciones más concentradas, el comportamiento se torna más complejo y difícil de analizar.
Katsotaanpa jokaista näistä neljästä ominaisuudesta yksityiskohtaisesti:
1. Liuottimen höyrypaineen päätös
Kun valmistetaan haihduttamattoman liuennin liuos, tuloksena olevan liuoksen höyrypaine on aina pienempi kuin puhtaan liuottimen höyrynpaine. Toisin sanoen liuottavan haihduttamattoman liuenneen aineen liuottimeen aiheuttaa mainitun liuottimen höyrynpaineen vähentymisen puhtaan liuottimen verrattuna.
Höyryn paineen kaava vähenee
Kuten kaikki kolgatiiviset ominaisuudet, höyrynpaineen (DP) lasku on verrannollinen liuenneen aineen pitoisuuteen. Yhdistämällä Raaultin laki molaaristen fraktioyhtälöiden kanssa, voidaan osoittaa, että DP on antanut:
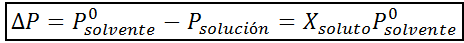
missä p °liuotin edustaa puhtaan liuottimen höyrynpainetta tietyssä lämpötilassa, Pratkaisu vastaa liuoksen höyrynpainetta ja xliuennut edustaa liuenneen aineen konsentraatiota, joka ilmaistaan molaarisena fraktiona.
Miksi vähentää höyrynpainetta liuenneen aineen kanssa?
Voima, joka ajaa luonnollisimpia prosesseja, kuten liuottimen haihtumista, on entropian tai häiriön tason nousu. Kun neste haihtuu, se siirtyy hyvin järjestetystä tilasta (nesteessä) erittäin sotkuiseen (kaasussa), koska kaasufaasissa on paljon enemmän liikkumisvapautta.
Voi palvella sinua: Violet lasiLiuoksessa kuitenkin liuenneen aineen läsnäolo lisää häiriöitä nestemäiseen faasiin, mutta ei vaikuta kaasufaasiin (koska liuennettu aine ei haihtu).
Tästä syystä liuoksen ja kaasufaasin välisen häiriötason ero on pienempi kuin puhtaan liuottimen ja kaasufaasin välillä, joten liuottimella on vähemmän taipumusta haihtua toisessa tapauksessa.
Esimerkki
Ongelma: Tietäen, että vesihöyrynpaine tietyssä lämpötilassa on 30,55 mmHg, määritä valmistetun liuoksen höyrynpaine, joka liuottaa 7,20 grammaa glukoosia (moolimassa tai mm = 180 g/mol) 360 g vettä (mm = 18,0 g/mol) samassa lämpötilassa.
Ratkaisu: Tässä tapauksessa liuenneen aineen molaarinen osa on laskettava ensin. Meillä on jo kaikki tarvittavat tiedot tähän:
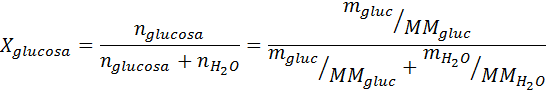
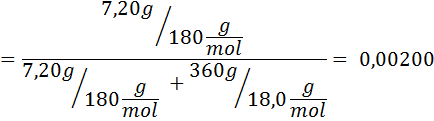
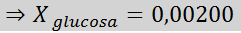
Silloin höyryn paineen vähenemisen yhtälö.
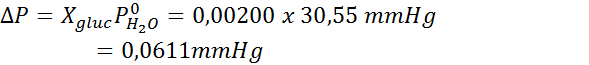
Nyt määrittelemme liuottimen uuden höyrynpaineen:
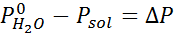
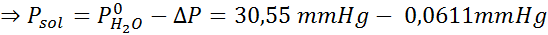
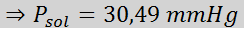
2. Ebullloskooppinen korkeus- tai kiehumispiste
Ebullloskooppinen korkeus viittaa liuoksen kiehumispisteen kasvuun verrattuna puhtaan liuottimen kiehumispisteeseen. Ymmärtääksesi miksi näin tapahtuu, muista, että kiehumispiste määritetään lämpötilana, jossa nesteen höyrynpaine tehdään yhtä suureksi kuin ilmakehän paine.
Koska liuoksilla on pienempi höyrynpaine kuin puhtaan liuottimen (kuten olemme juuri nähneet edellisessä osassa), on tarpeen lämmittää sitä enemmän, jotta voidaan saavuttaa ilmakehän paine ja saavuttaa siten kiehumispisteen. Tästä syystä ratkaisujen kiehumispiste (ei -haihduttavilla liuenneilla aineilla) on aina suurempi kuin puhdas liuotin.
Ebullloskooppinen korkeuskaava
Kiehumispisteen kasvu (DTb -;
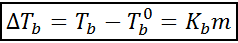
Missä tb - Se on liuoksen kiehumispiste, tb -° Se on puhtaan liuottimen kiehumispiste, kb - Se on liuottimen ebullloskooppinen vakio ja m Se on liuenneen aineen molealiteetti.
Esimerkki
Ongelma: Tietäen, että veden kiehuva vakio on 0,52 ° C.kg/mol, määritä edellisessä esimerkissä valmistetun glukoosiliuoksen kiehumispiste.
Ratkaisu: Ebullloskooppisen korkeuden määrittämiseksi tarvitsemme vain moraalia.
Voi palvella sinua: Tinoksidi (II): rakenne, ominaisuudet, nimikkeistö, käyttö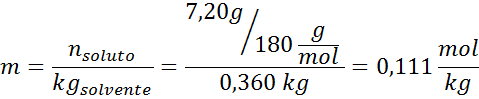
Nyt käytämme DT -kaavaab --
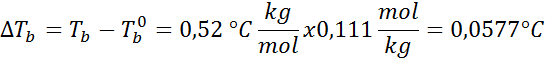
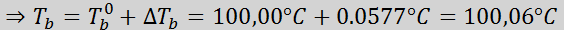
3. Kriokooppinen laskeutuminen
Krykooppinen lasku on liuoksen jäätymispisteen lasku verrattuna puhtaan liuottimen jäätymispisteeseen. Syy siihen, että tämä tapahtuu.
Tätä kiinteistöä käytetään laajasti kylmällä säällä, missä lumi talvella. Näissä maissa on hyvin yleistä nähdä kuorma -autoja levittävän suoloja, kuten NaCl tai CACL2 teillä tai julkisilla penkeillä, minkä jälkeen lumi sulaa. Syy, jonka se sulaa, on se, että suola vähentää veden jäätymispistettä.
Kriokooppinen laskeutumiskaava
Chrioskooppinen laskeutumisyhtälö on hyvin samanlainen kuin ebullloskooppinen lisäys. Se on myös verrannollinen moraaliseen pitoisuuteen ja riippuu tässä tapauksessa liuottimen kryoskooppisesta vakiosta.
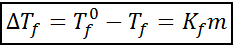
missä tF Se on liuoksen jäätymispiste, tF° Se on puhtaan liuottimen jäätymispiste, kF Se on liuottimen chrioskooppinen vakio ja m Se on liuenneen aineen molealiteetti.
Esimerkki
Ongelma: Tietäen, että krykooppinen vesivakio on 1,86 ° C.kg/mol, määritä edellisessä esimerkissä valmistetun glukoosiliuoksen jäätymispiste.
Ratkaisu: Ratkaisun moraali määritettiin jo, joten voimme suoraan määrittää DT: nF Edellisen kaavan käyttäminen:
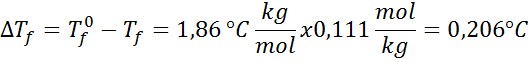
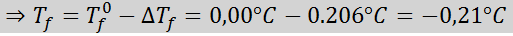
4. Osmoottinen paine
Osmoosi on erittäin tärkeä prosessi kemiallisella ja biologisella tasolla. Tämä koostuu liuotinmolekyylien virtauksesta (esimerkiksi vedestä) laimennetusta liuoksesta toiseen konsentroituneempaan liuokseen, kun ne erotetaan puolijalkavertaisen kalvon avulla (jonka avulla vain liuotin vain kulkee, mutta ei liuenneen aineen) avulla).
Tämä taipumus "absorboida" liuotin puolijalkavertaisen kalvon kautta on ominaisuus, joka riippuu yksinomaan liuoksessa olevien liuenneen hiukkasten kokonaispitoisuudesta riippumatta siitä, mikä liuenneaine se on. Tästä syystä tämä suuntaus on kolgatiivinen ominaisuus, ja sitä mitataan osmoottisen paineen avulla.
Osmoottinen paine (π) on paine, jota tulisi kohdistaa liuokseen osmoosin pysäyttämiseksi. Mitä suurempi osmoottinen paine, sitä enemmän taipumus liuotin absorboida liuotin (tai tarkemmin, sitä enemmän trendi liuotin leviämään siihen liuokseen) on liuos).
Voi palvella sinua: Magnesium: historia, rakenne, ominaisuudet, reaktiot, käyttötarkoituksetMiksi osmoosi tapahtuu?
Osmoosiprosessin taustalla oleva selitys on hyvin yksinkertainen. Kaikilla aineilla on taipumus levitä siitä, missä ne ovat keskittyneempiä missä ne ovat laimennettuja. Tätä käsketään seurata keskittymisgradienttiasi.
Kun liuos on tiivistetty enemmän liuenneen aineen suhteen, se on samanaikaisesti laimennettuna liuottimessa ja päinvastoin. Tästä syystä liuottimella on luonnollinen taipumus siirtyä laimennetuimmasta liuoksesta (missä liuotin on tiivistyneempi) kohti konsentroitua liuosta (missä se on laimennettu).
Osmoottinen painekaava
Osmoottinen paine voidaan laskea kaavalla, joka on hyvin samanlainen kuin ihanteellisten kaasujen yhtälö:
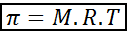
Tässä yhtälössä π on osmoottinen paine, m on liuenneen aineen molaarinen pitoisuus, r on ihanteellisten kaasujen yleinen vakio (0,0821 atm.L/mol.K) ja t on absoluuttinen lämpötila k: ssä.
Osmoottinen paine ja toniikka
Osmoottinen paine on erittäin tärkeä ihmiskehon toiminnalle. Itse asiassa suonensisäisesti injektoidut suolaliuosratkaisut luokitellaan sen mukaan, onko niiden osmoottinen paine suurempi, yhtä suuret kuin veren plasman kanssa kuin niin kutsuttu tonicity.
- Vähemmän konsentroitua liuosta, jolla plasmalla on alhaisempi osmoottinen paine ja joka kerrotaan Hypotoninen ratkaisu.
- Jos sinulla on sama liuenneiden aineiden kokonaispitoisuus, se kerrotaan isotoninen ratkaisu.
- Jos sinulla on suurempi osmoottinen (tai pitoisuus) paine, se kerrotaan hypertoninen ratkaisu.
Esimerkki
Ongelma: Laske osmoottinen paine 310 K: ssa 0,9 -prosenttista suolaliuosta (m/tilavuus), joka on isotoninen veriplasman kanssa.
Ratkaisu: Meillä on jo lämpötila, joten puuttuva asia on määrittää suolahiukkasten (NaCl) molaaripitoisuus liuoksessa. Tätä varten.
Jokainen 100 ml liuosta sisältää 0,9 g NaCl, niin:
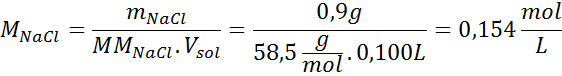
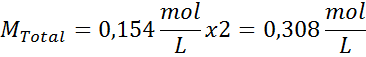
Tämä on liuoksen liuenneiden hiukkasten kokonaispitoisuus, joten nyt voimme laskea osmoottisen paineen: